第三篇标准状态和标准电极电位测量
a) 何谓标准状态~
什么是标准状态呢? 这是解决问题的关键所在。其实对标准状态的选择基本上是任意的。 只是为了实用方便而被选中。
通常,单质或化合物的标准状态是指在标准压力(一个大气压)和温度(通常为25°C)下,进行实验的的纯物质。 在前面的例子中,金属银和固体氯化银为纯物质时,它们都处于标准状态。
另一方面,溶解在溶液中的物质(也就是溶质)的标准状态是指其活度为1的状态,活度是表示溶质的有效浓度(摩尔分数、质量摩尔浓度、体积摩尔浓度等)的单位。接下来,我们将使用大家熟悉的体积摩尔浓度。
一般来说,对于任意的一个化学物质A,可以用式12来表示其化学势(化学能)。
γA 为活度系数,Co为标准浓度(1 mol dm-3)
当化学物质A的浓度降低到极限时,其活度系数无限接近1。
此时,溶质之间或溶质与溶剂之间的相互作用变得可以忽略不计,接近理想状态。 标准状态就是被假设为处于这种理想状态(活度为1的状态)时的化学物种的单位浓度。
或许可能有点难以理解,但重点是,应调整溶液的浓度,使溶质的活度为1 (当然,这只有在事先知道该物质的活度系数的情况下才有可能)。
b) 如何测量标准电极电位?
这样看来,如果想要直接从电动势测量中获得标准电极电位,只要构建如下面那样的电池2,让所有反应物种都处于标准状态的电池,并测量其电动势就可以了。 Cu(s)ΙPt(s)ΙH2(g, PH2=Po)ΙH+(αq,α=1 ),Cl-(αq, α=1)ΙAgCl(s)ΙAg(s)ΙCu(s) 根据 Nernst 公式,Harned 电池的电动势:可以表示为式16
但在实际上要组装这样的电池,是非常困难的。必须要配制氢离子和氯离子的活度同时为1的盐酸水溶液,该如何配制呢? 由于无法测量单个离子的活度系数,因此需要导入平均活度系数γ± 将上述的式16变换成 式17:
将氢离子浓度等于氯离子浓度等于盐酸浓度和氢气的分压等于标准大气压恒等于1代入后,进一步变换后,得到式18.
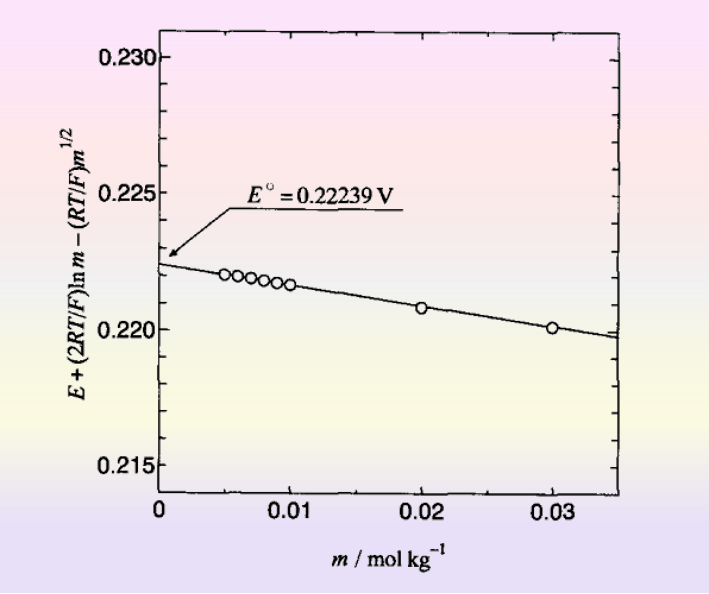
图5 从无限稀释时的电动势得到标准电极电位[2]
许多研究人员对银氯化银电极的标准电极电位进行了测量。但数值上的差异只是微伏的量级。详情请参阅参考文献[3]。
这样看来,似乎可以通过测量无限稀释时的电动势,来得到各种物质的标准电极电位。 但是,这种方法并不能用于所有的情况(可以测量的体系非常少)。 例如,目标反应的反应速度很慢(因为对测量平衡电位这是一个问题),发生副反应,形成表面膜等等。在大多数情况下无法实际测量。 即使在这种情况下,标准电极电位还可以通过完全不同的方法获得。 换句话说,就是一种使用热力学关系的方法。
这样看来,似乎可以通过测量无限稀释时的电动势,来得到各种物质的标准电极电位。 但是,这种方法并不能用于所有的情况(可以测量的体系非常少)。 例如,目标反应的反应速度很慢(因为对测量平衡电位这是一个问题),发生副反应,形成表面膜等等。在大多数情况下无法实际测量。 即使在这种情况下,标准电极电位还可以通过完全不同的方法获得。 换句话说,就是一种使用热力学关系的方法。
参考文献
[2] H.S.Harned and R.W.Ehlers,J. Am. Chem. Soc., 54 (1932)1350.
[3] R G.Bates and J. B. Macaskill,Pure and Appl. Chem.,50(1978)1703.
