溶剂和支持电解质基础介绍连载
- 第一篇:关于溶剂
- 第二篇:溶剂相对介电常数的影响(1)
- 第三篇:溶剂相对介电常数的影响(2)
- 第四篇:溶剂的给体-受体性质和溶剂分类
- 第五篇:影响离子溶剂化的因素(上)
- 第六篇:影响离子溶剂化的因素(下)
- 第七篇: 有机溶剂中的酸碱平衡和pH值范围(上)
- 第八篇: 有机溶剂中的酸碱平衡和pH值范围(下)
- 第九篇:支持電解質
- 第十篇 电化学测量的电位范围(上)
- 第十一篇 电化学测量的电位范围(下)
- 第十二篇 溶剂对电极反应的的影响效果
- 第十三篇 支持电解质的影响效果
第一篇 关于溶剂
说起溶剂,我们马上会想到水,的确水是一种很好的溶剂。然而,现在除了水之外还有许多优良的溶剂,其中一些被广泛用于电极反应。
这些溶剂可以大致分为1)主要由分子组成的分子性溶剂;2)由阴和阳离子组成的离子性溶剂。
分子性溶剂可分为水和非水溶剂两大类。而非水溶剂则可进一步分为有机溶剂和其它分子溶剂,比如氟化氢、液氨、二氧化硫等,除水以外的溶剂统称为非水溶剂。大多数离子溶剂是可以分为电解质的高温熔融盐,和最近受到广泛关注的在常温下为液态的离子性液体。
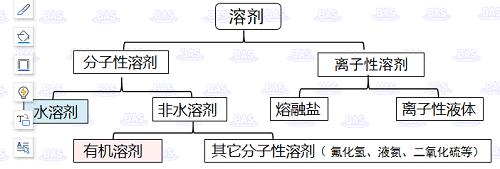
図1-1 溶剂类型示意图
例如,
1)可以溶解不溶于水的物质。
2)在水溶液中因与水反应而不稳定的物质(电极材料、电极反应物、中间体或产物等)可以稳定存在。
3)可以在比水溶液更宽的电位范围、pH 范围和温度范围内进行电化学反应的测量。
4) 通过改变溶质的溶解状态和反应性,可以使反应机理变得能更符合目标用途等。
如果有需要增加电极活性物质的溶解度,或者是需要限制氢离子参与电化学反应,以及需要进行低温测量以延长产物的寿命等的情况下,使用非水溶剂进行电化学实验就十分有效了。
并且,电化学方法也是解析溶剂本身的特性和溶质在其中的行为的最基本和有效的手段。
在讨论电极反应用的溶剂之前,需要先行回顾一下介电常数和相对介电常数这两个物理量的定义。
介电常数ε:当从外部施加电场时,物质中原子(或分子)产生的响应(介电极化的方式)所决定的常数。
相对介电常数εr:是介质的介电常数与真空的介电常数之比。 是一个无量纲量。
溶剂的相对介电常数 εr 是影响离子的溶剂化和电解质的解离的最重要的性质。
第二篇 溶剂相对介电常数的影响(1)
离子的溶剂化能与离子-溶剂相互作用的若干要素相关,其中静电溶剂化能ΔGel可以由以下Born公式表示[1]。
式(1)中,ze为离子的电荷; r 为半径; N为阿伏伽德罗常数; εr为相对介电常数。假设这个方程中 r 是常数,随着 εr的减小ΔGel 的绝对值便会减小。但在εr大于20 范围内的 ΔGel 绝对值的减小比较平缓,但会在εr小于10的范围内呈现急速减少。由于静电溶剂化能ΔGel 占据了离子总溶剂化能的大部分,相对介电常数(特别是εr<5)较小的溶剂因其静电溶剂化能ΔGel 绝对值变小,溶剂对离子的溶剂化作用一般较弱。
此外,溶液中的阳离子和阴离子可以各自以能使溶液导电的解离状态存在, 亦可如式(2)所示那样发生结合,以离子对的形式而存在。
假设溶剂化阳离子和溶剂化阴离子之间的缔合反应的常数为Kass,logKass大致可以用下面的Fuoss近似公式(3)表示。
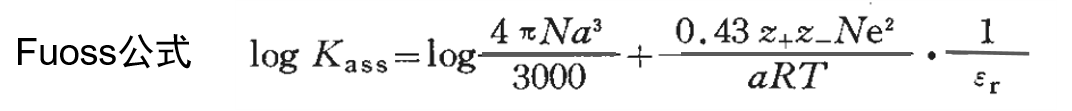
式中,z+e 和 z-e 是 M+ 和 X-的电荷,α 是M+ 和 X- 离子之间的最近距离 。
从式(3)可知,logKass与αεr的倒数几乎呈线性关系,可以预测如果相对介电常数εr越小,或离子之间的最近距离α越小,越容易形成离子对,其溶液的导电性降低.
下面来看一下α值较大的四丁基苦味酸铵的log Kass 和 εr倒数之间的关系,可以看到两者之间存在着较好线性关系。
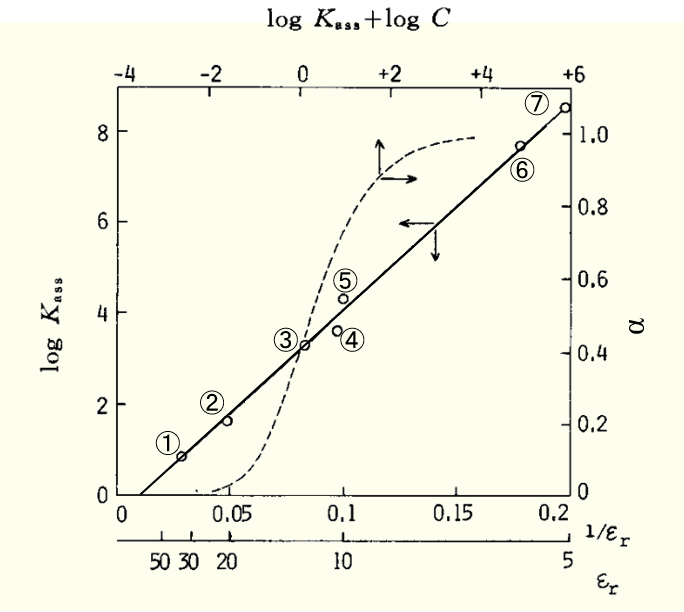
図1 Bu4NPic(四丁基苦味酸铵)的缔合常数与溶剂的相对介电常数εr的关系
溶剂:① C6H5NO2 , ② Ac, ③ Py, ④ CH2ClCH2Cl, ⑤ CH3CHCl2 , ➅ C6H5Cl, ⑦m-C6H4Cl2
(Y. H.Inami et al.,J. Phys.Chem.83,4745(1961).
虚线是缔合度 α 与 log(C Kass )(C: Bu4NPic 的摩尔浓度mol dm-3)之间的关系。
参考文献
[1] A. J.Bard,ed.,“Electroanalytical Chemistry”,Vol.3,C. K. Mann,Non-aqueous solvents for eiectro-chemical use,p.57(1969),Marcel Dekker.
第三篇 溶剂相对介电常数的影响(2)
固体电解质溶解在溶剂中并解离成游离离子的反应可以分为两步:固体溶解于溶剂形成 溶剂化离子对(enter↓), 溶剂化离子对 进一步解离生成溶剂化阳离子和溶剂化阴离子。
(M+, X-) 溶剂 ⇔ M+溶剂 + X-溶剂
(5)
对于上述这两个过程,溶剂的相对介电常数越大(亦或受其他因素的影响,使离子的溶剂化容易发生),就越容易向右移动。 用于电极反应的溶剂应该能溶解支持电解质,而且必须能在相当程度上解离成离子,所以经常使用相对介电常数较大(εr>20)的溶剂
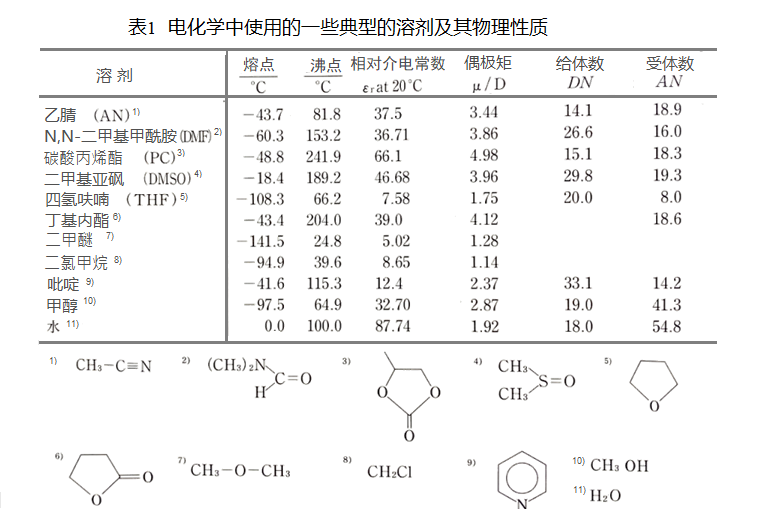
表1中例举了一些电化学中使用的一些典型的溶剂及其物理性质。
可以看到象乙腈,DMF, PC,DMSO,甲醇等电化学常用溶剂的相对介电常数远大于20。
特别要提一下水的εr非常大,所以水是一种非常好的电化学测量用的溶剂。
用于电极反应的溶剂应该能溶解支持电解质,而且必须能在相当程度上解离成离子,所以经常使用相对介电常数较大(εr>20)的溶剂。
然而,对于THF等这些相对介电常数较低的溶剂, 也可通过使用合适的支持电解质进行电极反应测量。
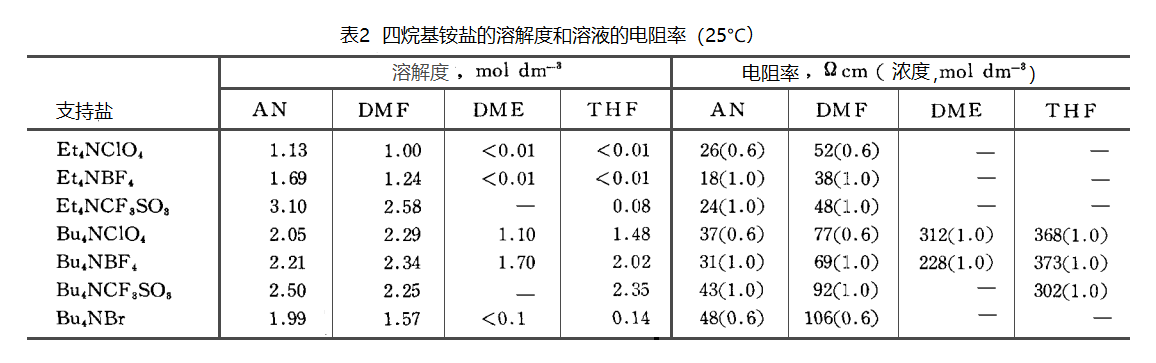
从表中的溶解度和电阻率看,对于乙腈,DMF这些相对介电常数远大于20的溶剂,各种四烷基铵盐均能较好地溶解在溶剂中,得到电阻率较小的电解质溶液。
但是,对于DME,THF这些相对介电常数较小的溶剂, 如果铵盐的烷基为乙基时,这些电解质盐在DME,THF溶剂中的溶解度很小,很难溶解,溶液的电阻率也无法测量。但是当铵盐的烷基为丁基时,它们在DME,THF溶剂中的溶解度大大增加,溶液的电阻率亦可以测量得到。
参考文献
[2] H.O.House,E.Feng and N,P.Peet,J. Org. Chem.36,2371(1971).
[3] K.Rousseau,G. C.Farrington and D.Dolphin,ibid. 37, 3968 (1972).
第四篇 溶剂的给体,受体性质和溶剂分类
溶剂的电子(对)给体性和受体性,可以和相对介电常数一起,成为溶液中发生的许多反应和平衡的主要影响因素。 特别是,当比较电极反应中使用的相对介电常数大的各种溶剂的溶质行为时,溶剂的给体性和受体性差异的影响,会比相对介电常数差异的影响更为显著。
作为溶剂给体性和受体性强弱的衡量标准,由Gutmann倡导的给体数(Donor number 用DN表示)和受体数(Acceptor number,用AN表示)被广泛使用[4][5].
给体数的测量方法是, 在弱给体的二氯乙烷中,样品溶剂(给体)(Body) 与 SbCl5 (强受体、较强的路易斯酸) 发生如方程式 (6) 所示的加成反应时生成产物的热量为给体数。DN值越大代表溶剂的给体性越强。
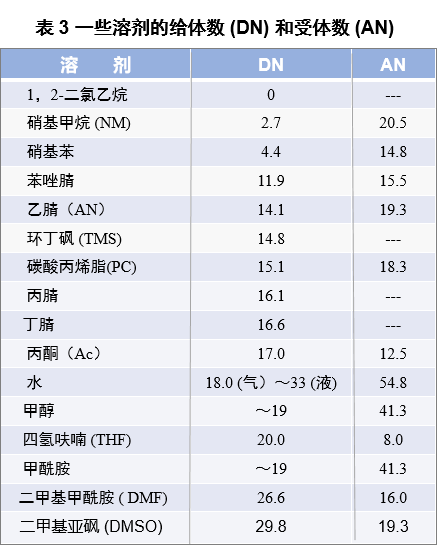

溶剂通常从布朗斯特酸碱, 即失去或得到质子的角度进行分类。表 4 是Kolthoff 教授的溶剂分类的例子 。 两性溶剂是指溶剂分子同时具有酸性和碱性。如果把溶剂用 SH 表示时,溶剂分子可释放出质子,可亦可这样接受质子。在两性溶剂中,那些酸性和碱性强度与水相近的溶剂为中性溶剂。
比水的酸性强得多,碱性要弱得多的溶剂比如硫酸,氢氟酸,甲酸,醋酸等是给质子性溶剂。相反比水的酸性弱,碱性要强得多的溶剂,比如乙二胺、NH3、甲酰胺等为亲质子性溶剂。
另一方面,非质子溶剂一般只有与碳原子键合的氢原子,因此释放质子和提供氢键的性质很弱。但是对于碱性则有强弱之分。强碱性是亲质子性的,而弱碱性则是疏质子性的。 非质子性溶剂中,偶极矩和相对介电常数较大的溶剂是极性非质子溶剂(Dipolar aprotic solvent),通常用于电极反应。
这是因为质子和氢键在这些溶剂中几乎不参与反应,这使得许多在质子溶剂(如水)中不可能出现的现象成为可能。在极性非质子溶剂中,AN、PC、TMS、NM等是疏质子性溶剂,对质子的亲和力很小,而DMF、等的这些溶剂则是亲质子性溶剂。乙腈(AN) 碳酸丙烯脂(PC) 环丁砜 (TMS) 硝基甲烷 (NM)。
在溶剂的碱性(给电子)起重要作用的反应中,这两组溶剂表现出明显不同的性质,因此需要根据目的适当选用。
参考文献
[4] V.Gutmann,“The Donor-Acceptor Approach to Molecular Interactions”,(1978),Plenum Press.
[5] V.Gutmann,Electrochim. Acta, 21,661(1976).
[6] I. M.Kolthoff,Anal.Chem.46,1992(1974)
[7] I. M.Kolthoff and P. J.Elving,ed.,“Treatise on Analytical Chemistry,”2nd ed.,Part I,Volume 2 (1979).
第五篇 影响离子溶剂化的因素(上)
离子的溶剂化涉及到离子-溶剂相互作用的多种因素,它们相互关联。 这些因素包括
1) 用布朗方程表示的静电相互作用
2) 给体-受体间的相互作用
3) 通过溶剂提供的氢键与阴离子的相互作用
4) 作为硬酸碱和软酸碱的相互作用
5) d10 阳离子的电子回馈给溶剂分子的相互作用
6) 因溶剂的结构形成和结构破坏而产生的相互作用。
静电相互作用产生的能量占总溶剂化能的很大部分,但在比较 常用的相对介电常数较大的溶剂的 溶剂化能时,其他因素的影响往往更大。
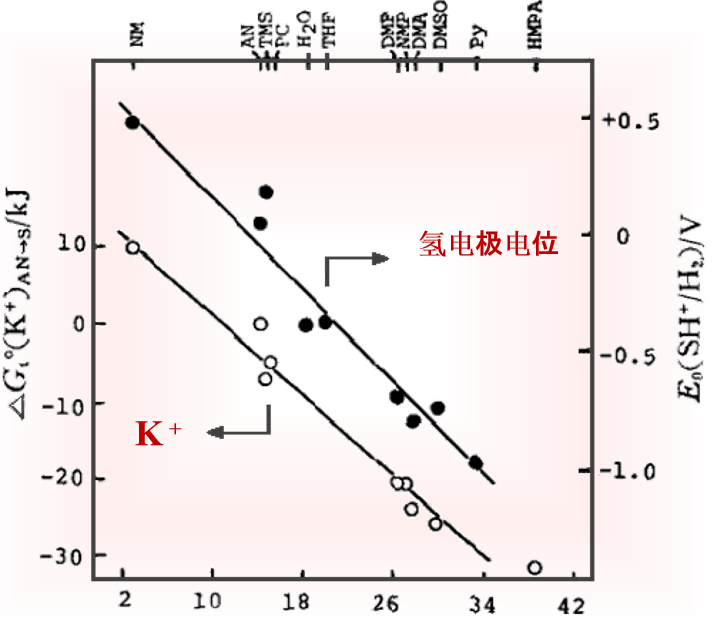
图 2 K+离子从 乙腈溶剂转移到其他溶剂的自由能(△Gt0(K+)AN→S)(〇), 以及各种溶剂中的氢电极电位(与H+离子的溶解能有线性关系)(●)随溶剂给体数DN 的变化[8.9 ].
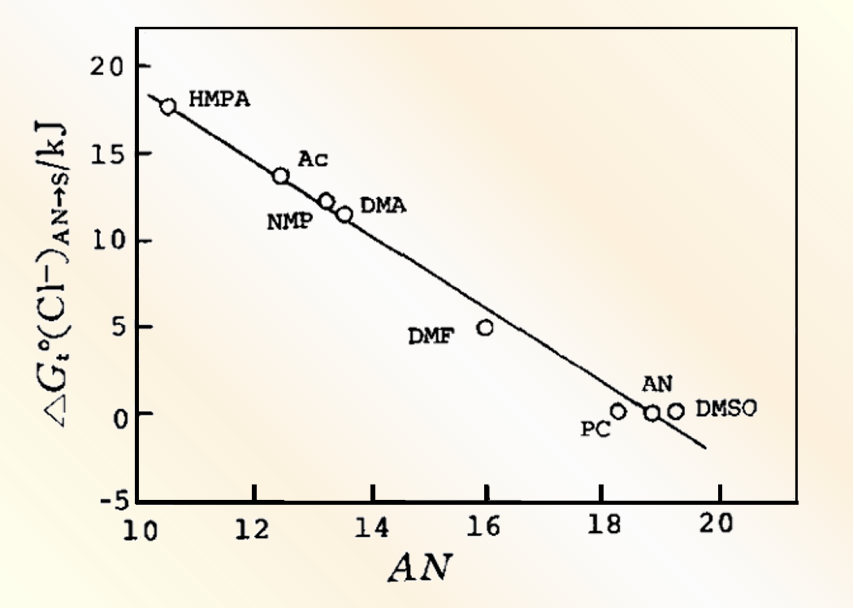
图3 Cl-离子从乙腈溶剂转移至其它非质子溶剂时的溶剂化能((△Gt0(Cl-)→S),随受体数(AN)的线性变化[8.9 ]
而对于一些大阴离子,比如碘离子和高氯酸根离子,一方面会因为其氢键接受的能力较弱,在水和醇溶剂中的溶解性变弱,但在另一方面,由于这些离子的极性较强,与具有类似极性的非质子性溶剂间分散力作用则会变强。这就是为何高氯酸根离子在水和醇中的溶剂化能和非质子溶剂中的溶剂化能没有太大的区别原因。
参考文献
[8] V.Gutmann,“The Donor-Acceptor Approach to Molecular Interactions”, (1978),Plenum Press.
[9] U.Mayer,Monatsh. Chem.108,1479 (1977).
第六篇 影响离子溶剂化的因素(下)
(c) 水分子间能形成氢键的结构,所以其熵值低。
水分子间能形成氢键的结构,所以其熵值低。当亲水性离子(很多无机离子是亲水性的)进入水中时,由于水分子和离子间的相互作用很强,会使离子周围的水的整体结构被破坏,使其之熵增大。
但是,当四烷基铵离子(R4N+)和四苯基硼酸根离子(Ph4B-)等疏水性大离子进入水中时,与离子疏远的周围水分子会进一步结合增加了它们的氢键结构(结构形成),使其之熵降低。
结果,这些疏水性大离子在水中变得不稳定,而在无氢键结构的有机溶剂中,则可以更稳定地存在(见表 5)。
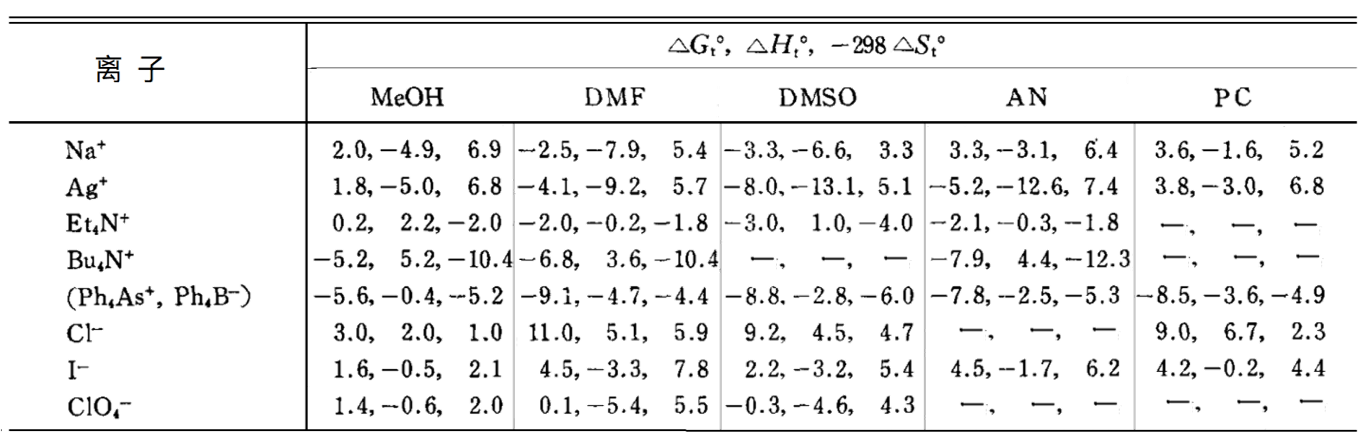 基于外热力学假设。△Gt0(Ph4As+)=△Gt0(Ph4B+),△Ht0(Ph4As+)=△Ht0(Ph4B+),△St0(Ph4As+)=△St0(Ph4B+)的关系成立。单位为kcal mol-1.
基于外热力学假设。△Gt0(Ph4As+)=△Gt0(Ph4B+),△Ht0(Ph4As+)=△Ht0(Ph4B+),△St0(Ph4As+)=△St0(Ph4B+)的关系成立。单位为kcal mol-1.
(D) 当考虑路易斯的酸碱相互作用时,有必要区分酸和碱的“硬”和“软”性质。
也就是说,硬酸与硬碱,软酸与软碱之间容易产生相互作用。 即使在金属离子的溶剂化中,这种效果也可能很明显。
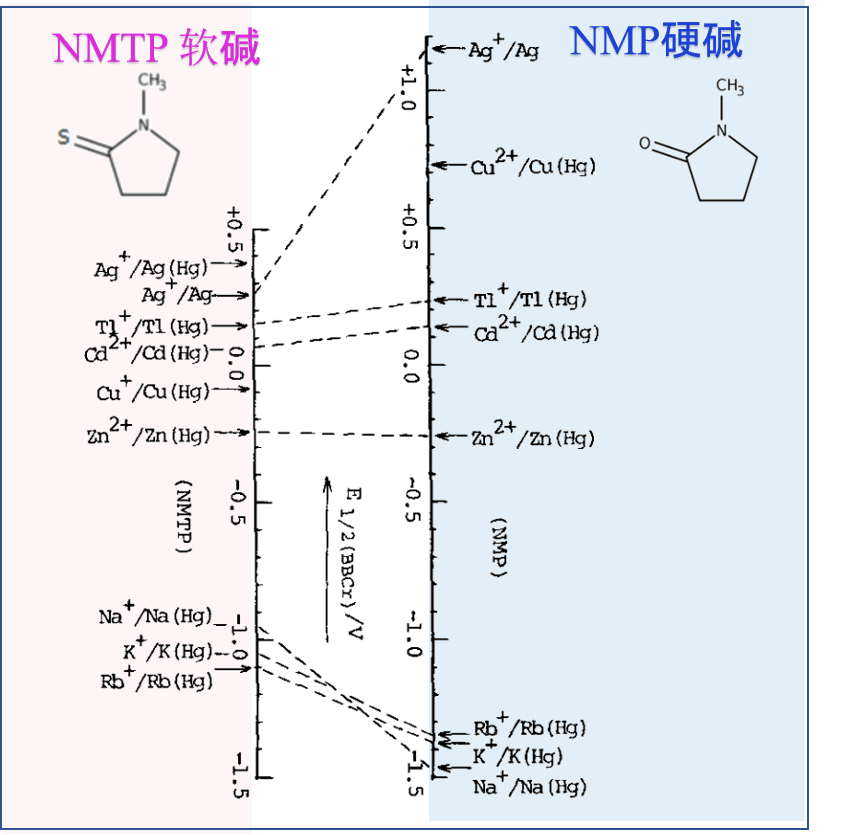 图4 N-甲基吡咯烷酮 (NMP) 和 N-甲基硫代吡咯烷酮 (NMTP) 中的金属离子半波电位比较 (vs. E1/2 of bisphenyl chromium (I) )
图4 N-甲基吡咯烷酮 (NMP) 和 N-甲基硫代吡咯烷酮 (NMTP) 中的金属离子半波电位比较 (vs. E1/2 of bisphenyl chromium (I) )
(e) 乙腈 (AN) 的 给体数DN 值相对较小,因此在乙腈中金属离子的溶剂化作用一般较弱。
然而,一价的金属离子如Ag+和Cu+在乙腈 (AN) 溶剂中则不同,具有非常强的溶剂化作用和稳定性。 (比较表5中乙腈 和丙烯碳PC中的Ag+ΔGt0)。 这是因为d 电子从金属离子回馈给腈基。 因此,银离子和一价铜离子在乙腈溶剂中不易被还原为金属。
第七篇 有机溶剂中的酸碱平衡和pH值范围(上)
HA 型酸在溶剂中解离的反应可以分为如式 (8) 所示的两个步骤:
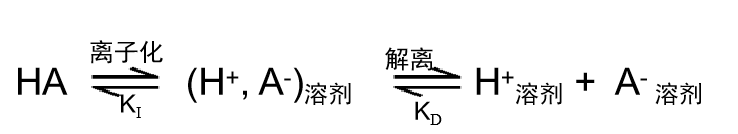
由此,为了使Ka变大,KI和KD都需要变大。也就是说酸 HA 的离子化过程和(离子对)的解离这两个过程必须都要容易发生。
在电离过程中,溶剂按
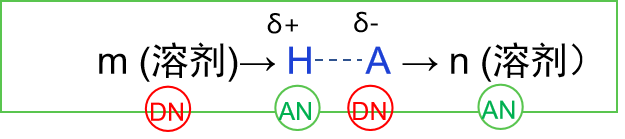
此外, 从前面提到的Fuoss公式 (3) 中可以看出,溶剂的相对介电常数越大以及 H+和 A-离子之间的最近距离越大, 溶剂化离子对 (H+, A- )的解离会越容易。
对于HA型酸, 除了解离反应,还可以发生这样的同质共轭反应,同质共轭反应常数KfHA2- 的值在表6中的括弧内表示。
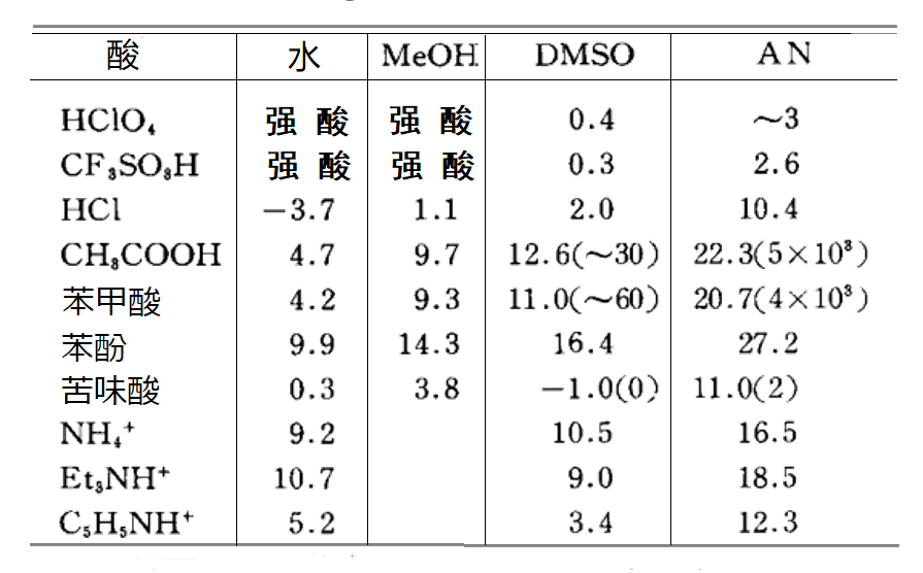
水的给体性和受体性比较强,且相对介电常数大,是一种容易使酸发生解离的溶剂。
另一方面,给体性和受体性均比较弱的乙腈溶剂中,H+ 难于发生溶剂化,还有A- 离子的溶剂化作用往往也难以发生。因此酸的 pKa很大,几乎没有可以完全解离的酸。然而,在具有强供体性质的DMSO中,H+ 被强溶剂化,因此pKa比在乙腈中的小,并且相对容易溶剂化阴离子的苦味酸等酸可以完全离解。
表6显示了BH+型酸的BH+ ⇔ B + H+ 的解离 pKa,这种类型的酸的解离受BH+ 、B、H+的溶剂化作用强度的影响,其中H+ 的溶剂化作用的影响相对较大。因此,乙腈(AN)中的pKa要比DMSO中的pKa大得多。DMSO中的pKa通常与水溶液中的pKa大致相同。
参考文献:
[10] I. M. Kolthoff and P. J. Elving ed.,“Treatise on Analytical Chemistry,”2nd ed. Part I,Volume 2 (1979).
第八篇 有机溶剂中的酸碱平衡和pH值范围(下)
在极性有机溶剂中,就像在水溶液中一样,可以通过将弱酸HA与其共轭碱A-(使用具有高溶解度的四烷基铵盐)或弱碱B与其共轭酸BH+(例如使用高氯酸盐)混合制成pH缓冲溶液。
然而,在HA-A-型缓冲溶液中,HA和A-可以同质共轭反应形成HA2-
共轭反应: HA + A- ⇆ HA2-
共轭反应常数: KfHA2- = [HA2-] /([HA] [A-])
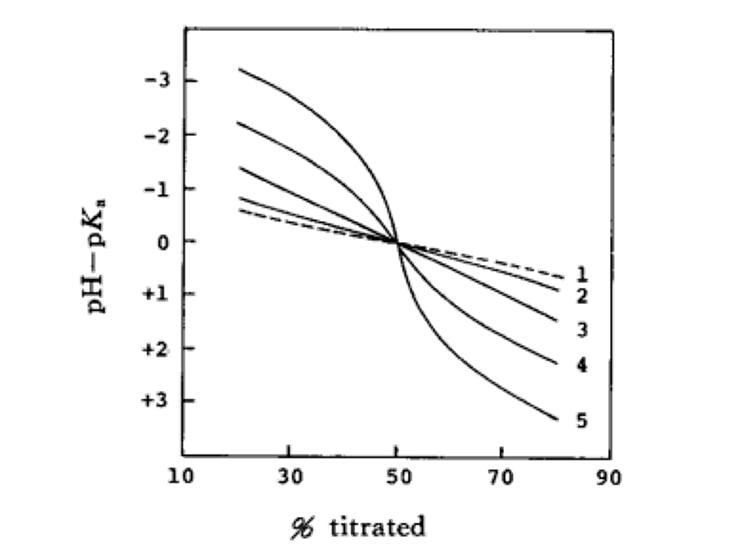
图5 同质共轭反应对用Et4NOH滴定HA酸的滴定曲线的影响)
CHAKf HA2-:1) 0(无同质共轭的情况下); 2)1; 3)10; 4)102; 5)103
如图5为同质共轭反应对用 四乙基氢氧化铵(Et4NOH)滴定HA型酸的滴定曲线的影响。无同质共轭反应作用时的滴定曲线为一条直线,随着共轭反应常数Kf的增加,滴定曲线偏离直线的程度就会变得越大。
HA-A-型缓冲溶液的组成和缓冲能力之间的关系比较复杂,当HA和A-的溶解度都比较低、反应性比较强时,就会发生同质化共轭反应。
在前面的表4中, 溶剂被分为两性和非质子性的两大类。如果我们用SH表示两性溶剂,则其发生的自电离反应可表示如下。
对于非质子性溶剂,一般由于给质子性非常弱,很难得到对应于 S-离子的化学成分,即使能发生微弱的自电离,得到的KSH 值往往也会不太准确。水在25度时的自电离常数,即水的离子积为10-14,可用于测量的pH值范围大致为0-14。同样,根据上面得到的KSH值,各种溶剂可以测量的pH范围如图6.中所示。

图 6 各种溶剂中的 pH 值范围(基于水的值)。
( ) 内表示的是 -logrt (H +W → SH , pKSH)
溶剂的给体数越小,其碱性越弱,则其酸性区域就越宽。而溶剂的受体数越小,其酸性越弱,则其碱性区域就会越宽。疏质子的非质子性溶剂, 其酸性和碱性范围均有比水宽的特点,可以加以利用。
在酸性范围较宽的溶剂中的较强的酸,或在碱性范围较宽的溶剂中的较强的碱,可以不与溶剂发生反应,保持其原本的状态存在。这可用于非水溶剂滴定中强酸和强碱的混合物的差分定量,但当电极反应中使用适当的溶剂时,作为中间体或产物的强酸性(受体性)和强碱性(给体性)物质可以稳定存在,这就是使用有机溶剂进行电极反应的重要原因之一。
第九篇 支持電解質
作为电化学测量用电解质应该满足以下要求
1)应在溶剂中有相当大的溶解度,使电解液有足够的导电性。
2) 并且可测量的电位范围应该较宽。
3)还必须满足不与溶剂或参与电极反应的各种物质发生反应,或不会产生改变双电层等不利影响等的条件。
因此,与水溶液中使用的支持电解质相比,可用于有机溶剂中的支持电解质的种类相当有限。
关于各种溶剂中使用的支持电解质的详细情况请参考文献【1和 11】。

* X-:卤素离子,R4N+:四烷基铵离子(尤其是 Et4N+、Bu4N+)
然而,高氯酸盐在干燥时有爆炸的危险。 使用时必须小心。近年来,代替高氯酸盐,四氟硼酸盐(BF4-)盐 和六氟磷酸盐(PF6-)盐,三氟甲磺酸盐的使用增加, ,特别是在氧化反应的研究中 这些盐已被证明优于高氯酸盐。
在 DME 和 THF 等低介电常数溶剂中,电解质难于溶解和解离成离子,所以可使用的电解质的种类就更少,但即使在这些溶剂中这些具有大离子半径的阴阳的电解质还是能较好溶解,并且可提供相当的导电性(见表2)。
参考文献:
[11] 長哲郎編,“電極反応の基礎”,伊豆津公佑,非水溶媒,p.31;藤平正道,プロトン付加反応,p,109; 長 哲郎,支持電解質,p.177(1973),共立出版。
第十篇 电化学测量的电位范围(上)
可用于电极反应测量的电位范围(在溶解了支持电解质的溶液中,可获得残余电流的电位范围) 在很大程度上取决于组成电解液的溶剂和支持电解质、以及用于测量的电极类型及其表面状况。下面,以汞电极和铂电极为例,先讨论负电位方向的电位极限。
对于汞电极 : 由于汞电极上氢的过电位大,酸性溶剂除外,通常支持电解质的阳离子会在溶剂之前被还原。由于四烷基铵离子可以还原为汞齐 R4N (Hg) n而稳定存在,所以适合作为还原反应的支持电解质。 这种汞齐在非质子性溶剂如乙腈和二甲基甲酰胺等中可以相对稳定地作为电极表面的薄膜存在,但它在水溶液中立即与水反应。由于碱金属离子可以与汞形成稳定的金属汞齐。可在高于四烷基铵离子0.5 至 1 V 的正电位处发生还原。在汞电极中,即使含有杂质水分子,负电位极限也不会有太大变化。
对于铂电极: 在质子性溶剂中,如在水存在的情况下,负电位的极限为水还原产生氢气的电位。 但在非质子性溶剂中,支持性电解质中的阳离子的还原往往会成为负电位极限。 碱金属离子的还原电位会因其溶解度的强弱而出现很大的变化,可能比四烷基铵阳离子的还原电位更正或更负。碱金属离子在许多非质子性溶剂中被还原,沉积在电极上,但当Na+、Li+等,在强供体性HMPA中作为支持电解质的阳离子时,从电极表面产生的蓝色溶出电子进入溶液,成为负电位方向的极限。

注: 括号中显示的是电流密度为10 µA/mm2时的支持性电解质种类。
1)HClO4 2) LiClO4 3) NaClO4 4) Et4NClO4 5) Bu4NC1O4 6) Hep4NC1O4 7) Et4NBF4 8) KPF6
表8的蓝色背景部分,为铂电极在各种溶剂中的可测负电位的极限。可以看到在许多情况下,铂电极的负电位范围比汞电极的更宽。
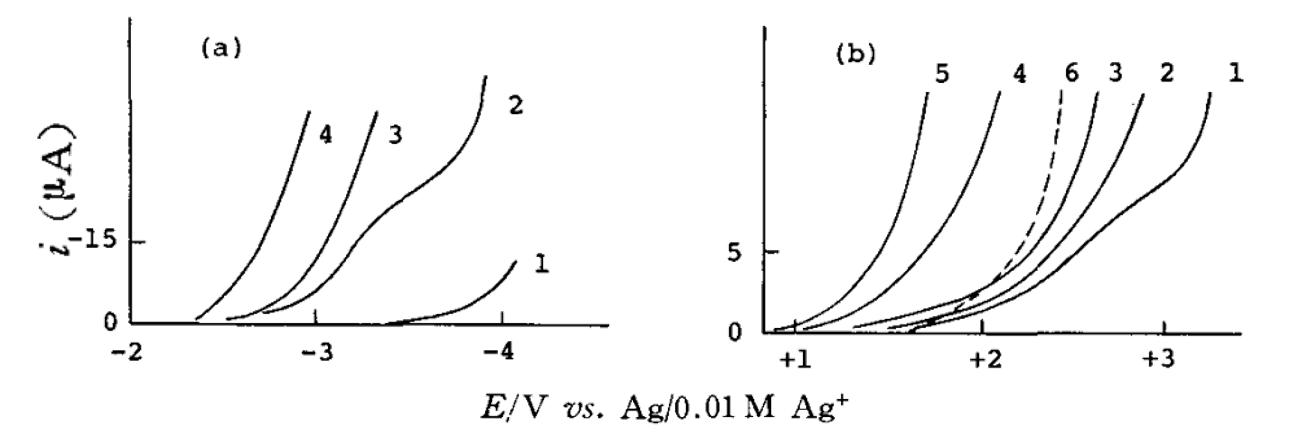
图7 水含量对PC溶剂中铂金电极上残余电流的影响[12]
(a) 0.1M Bu4 NClO4 中的负电位方向。 水的浓度: 1, ~0M; 2, 0.01 M; 3, 0.03 M; 4, 0.1 M
(b) 在0.1M KPF6中的正电位方向。 水的浓度:1, 0.01M; 2, 0.03 M; 3, 0.1 M; 4, 0.5 M; 5, 1 M (6 是在0.1M LiClO4中,水浓度为 0.001 M)
参考文献
[1] A.J.Bard, ed.,“Electroanalytical Chemistry”,VoL8, D.Bauer and M Breant,Solute behavior in solvents and melts,a study by use of transfer activity coefficients,p.281(1975),Marcel Dekker.
[12 ] J. Courtot-Coupez and M.L’Her,Bull.Soc.Chim. Fr.1970,1631)
第十一篇 电化学测量的电位范围(下)
下面讨论正电位方向的极限。
对于汞电极, 其正电位的极限就是汞的氧化溶出电位。当使用高氯酸盐作为支持性电解质时,正电位极限为0至+0.4 V。在有卤素离子存在的情况下,汞的氧化溶出电位会向负方向移动,特别在难以发生阴离子溶剂化作用的非质子性溶剂中,这种正电位极限的电位负移会更加明显。
对于汞电极 : 由于汞电极上氢的过电位大,酸性溶剂除外,通常支持电解质的阳离子会在溶剂之前被还原。由于四烷基铵离子可以还原为汞齐 R4N (Hg) n而稳定存在,所以适合作为还原反应的支持电解质。 这种汞齐在非质子性溶剂如乙腈和二甲基甲酰胺等中可以相对稳定地作为电极表面的薄膜存在,但它在水溶液中立即与水反应。由于碱金属离子可以与汞形成稳定的金属汞齐。可在高于四烷基铵离子0.5 至 1 V 的正电位处发生还原。在汞电极中,即使含有杂质水分子,负电位极限也不会有太大变化。
对于铂电极,从 表8中可以看到,如果高氯酸盐(R4N+ ,Li+ 或Na+ 盐)被用作支持性电解质,那么在象DMSO,DMF等的强给体性溶剂中,溶剂本身的氧化成为正电位方向的极限,如果溶剂是弱给体性溶剂,如乙腈等,则受限于高氯酸根离子的氧化电位。从表中可以看出 四氟硼酸盐(BF4-)盐 和六氟磷酸盐(PF6-)盐比高氯酸盐更适用于氧化反应的测量。
例如在硝基甲烷溶剂NM中高氯酸根离子的正电位极限为+2.3V,而BF4-离子为+2.9V(与Fc/Fc+ 相比)
在疏质子的非质子性溶剂(如 碳酸丙烯脂PC等)中, 可测量的总的电位范围可达到约 6—7V。而在水溶液中即使在负电位方向用汞电极测量,在正电位方向用铂电极测量,可测量的总体电位范围也在5V以下。
因此从电位范围的角度来看有机溶剂比较有优势,那些在水溶液中不可能进行的各种电极反应,可以在有机溶剂中进行。
第十二篇 溶剂对电极反应的的影响效果
溶剂性质,支持电解质性质,以及两者的行为变化对电极反应会产生各种各样的影响。
先来看溶剂对电极反应的的影响效果
●对金属离子和配合物的电极反应的影响
1) 对于金属离子还原成金属((或金属汞齐)的电位,会随着金属离子在溶剂中的溶剂化作用的增强而向负电位方向移动,这种电位的负移与离子的溶剂化能之间存在着热力学的对应关系。 溶剂对极谱半波电位的影响经常被用为比较金属离子溶解能化的手段。
2)由于在非质子溶剂中不易发生因溶剂产生的分解,那些在水溶液中因发生水解而得不到良好极谱图的碱土金属、铝、锆等离子,也能得到较好的还原波。
还有,那些会与水反应的活性金属,比如碱金属Na,K等,也可以在非质子溶剂中在电极上析出。
3) 在非质子性溶剂中,通过电极反应产生的低价态金属配合物可以稳定存在[13][14] 。
例如二价铁的联吡啶配离子[Fe(bipy)3]2+在水溶液中发生2电子还原,一步生成零价铁的配合物,然而在非质子性溶剂中则会发生1电子3步的可逆还原步骤,产生比较稳定的[Fe(bipy)3]- 如下。
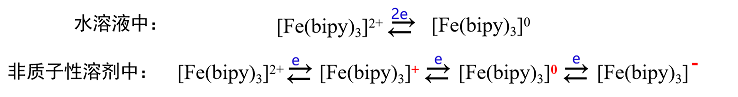
此外Cr、Ni、Ru 联吡啶络合物等各种络合物也同样如此。
这是因为非质子溶剂的酸性较弱,难以与配合物的配体(碱)反应。从可以得到不依赖于溶剂的电位参考标准的角度来看,这些反应体系值得引起大家的注意。
此外,由于那些不溶于水的配合物和有机金属化合物通常可以溶解在有机溶剂中,因此对这些电极反应进行详细的研究。
●对有机化合物的电极反应影响
许多有机化合物(R)在水溶液中通过2电子还原,一步生成加氢还原产物 RH2 (方程式 11)。
然而在非质子性溶剂中,还原反应的机理,则会分成2个一电子还原步骤,先是1电子还原生成一个相当稳定的阴离子自由基,再进一步得到一个电子还原成R2-阴离子。
这一现象在有机溶剂应用于电极反应的历史上非常重要,并被广泛地研究。通过研究发现,随着溶剂受体数的增加,第一步还原生成阴离子自由基的半波电位会 出现正向线性移动。 Aoyagi 等,用铂电极在 0.4M 四丁基高氯酸铵盐的DME溶液中,实现了环十轮烯烃分子的4个1电子可逆氧化还原步骤。并在 DME 中得到了相对稳定的相当于R4-的活性阴离子。
还有, 在极性疏质子的非质子性,例如:乙腈(AN) 碳酸丙烯脂(PC) 硝基甲烷 (NM),环丁砜 (TMS) 等溶剂中,通过使用适当的支持性电解质,可以测量至相当高的正电位,甚至能观察到难以氧化的苯的氧化。
亲质子性溶剂和水溶液中: R•+ + 溶剂 ⇔ R•+溶剂
疏质子性溶剂中的自由基聚合: nR•+ → Rn
(15)
(16)
有机化合物的氧化常常会在第一步生成阳离子自由基(R⇄ R+ + e),其通常比相应的阴离子自由基更不稳定。 在亲质子性溶剂和水溶液中,这些阳离子自由基会与溶剂发生反应。但是如果在疏质子性溶剂中,因为溶剂和阳离子自由基之间不会发生反应,此时可以发生自由基的聚合反应。
因此,进行氧化反应测量时,有必要使用给体性(碱性)强弱合适的溶剂,以实现目标的反应[15]。
参考文献
[13] T.Saji and S. Aoyagui,Inorg.Nucl. Chem. Lett. 2, 359 (1966).
[14] T.Saji and S. Aoyagui,Electrochim. Acta 13, 335(1968).
[15] T.Saji and S. Aoyagui,J. Electroanal. Chem.102, 139(1979).
第十三篇 支持电解质的影响效果
由于支持电解质的阳离子和阴离子会与极性相反的物质或产物发生反应,从而会对电极反应产生各种影响。
1) 当金属离子与电解质盐的阴离子形成离子对或配合物时,金属离子的还原电位会变得更负。
2) 金属离子在给体性越强的溶剂中,电解质盐的阳离子半径越大,金属离子就越容易还原 (还原电位变得更正)
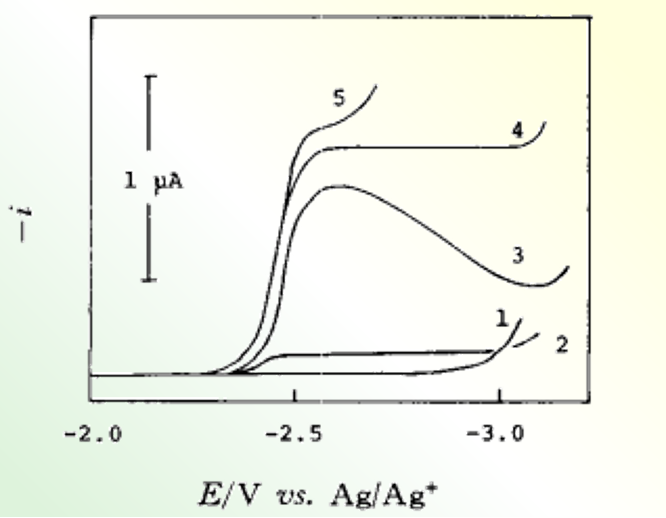
图8 支持电解质的阳离子对HMPA中Na+还原波的影响
1,Me4N+,Et4 N+ ; 2, Bu4N+ ; 3, Hex4N+ ; 4,Hep4N+ ;5,Li+(各0.05 M ClO4-盐)。 Na+浓度为0.5 mM。
当电解质阳离子的半径进一步变大时,比如锂离子、四庚基铵根离子等情况下,Na+离子的还原波形接近于可逆的扩散控速波形。
这种现象可以定性地解释如下:
在负电位下,半径小的阳离子优先被吸引靠近电极表面,而较大的阳离子则因为较小的阳离子的存在而无法接近表面。当电解质阳离子稍稍变大时,如四丁基铵根离子,这种影响会变小,一些Na+在靠近电极表面的地方被还原(通过渗透或脱溶剂化作用)。 当阳离子进一步变大时,几乎没有干扰效应,得到了扩散控速还原波。
由此可见,支持电解质的阳离子在负电位下对金属离子还原的影响在给体性(碱性)最强HMPA中非常显著,在给体性强的DMSO、DMA,DMF等溶剂中,碱金属和碱土金属离子的还原反应中普遍见到的现象。
但在弱给体性溶剂,如乙腈(AN)或 碳酸丙烯脂(PC) 中,这种现象则不太明显。
3) 支持电解质的阳离子对有机化合物还原的影响
图9 在 乙腈溶剂中金属离子对1,2-萘醌还原波還元波的影响
(1):0.05 M Et4NClO4,0.5 mM 萘醌,(2):(1)十5 mM K+ ,(3):(1)十5 mM Na+ ,(4):(1)十 5 mM Li+,(5): (1)十5mM Mg2+
可以发现,金属离子半径变得越小,或者电荷数越多,或者是象乙腈AN、或碳酸丙烯脂(PC) 那样给体性越小的溶剂中,越容易发生半波电位的正向移动。
我们知道这种离子对的形成促进了R∸阴离子自由基(R∸)的歧化反应和聚合反应。 因此,钠离子盐和锂离子盐不适合作为测量有机化合物还原反应的支持电解质。
在阴离子自由基进一步得到一个电子生成2价烷基阴离子的第二步的反应,会比第一步反应更容易受到支持电解质阳离子的影响。当有碱金属离子存在时,还原电位明显变正,究其原因,可以认为是 因为2价烷基阴离子比阴离子自由基更容易与支持电解质阳离子形成离子对。相反,当4烷基铵根离子的半径增加时,还原电位逐渐向负电位方向移动,究其原因似乎应该考虑由于双电层结构变化带来的影响。
参考文献
[17] K.Izutsu,S.Sakura and and T.Fujinaga,Bull. Chem. Soc..Japan 45,445(1972); 46,493,2148(1973).
[18] T. Fujinaga,K. Izutsu and T.Nomura,J. Electroanal. Chem. 29, 203 (1971)
