第8篇 电极反应理论(3): 电解质溶液中的传质与电极反应
电极反应是在两相,即电极和电解质溶液的界面上的非均相反应,为了使反应持续进行,附近溶液必须向界面方向进行物质(反应物和产品)的传输。例如,锌的电沉积(式39)反应,需要将溶液中的Zn2+离子从溶液本体中提供给界面,否则锌的电沉积无法进行。还有,对于Fe3+离子还原成Fe2+离子那样的反应(式40),如果产物也是能溶解在溶液中时,不仅必须向界面提供Fe3+离子,而且还必须不断地将产生的Fe2+离子从电极表面移除。
如果产生的Fe2+离子继续留在界面上,它们最终会超过溶解度并在界面附近沉淀出亚铁盐。 因此,溶液中的传质过程与电极反应过程一起在电化学反应中发挥着重要作用。
(40)
(41)
电解质溶液中离子转移的方式有扩散、对流、电泳三种方式,但对流的作用并不能到达电极附近,这部分的电解液基本处于静止状态。这个静止区域称为能斯特扩散层。其厚度δ取决于溶液的搅拌程度和粘度,一般在水溶液中为 10-2 到 10-3厘米左右。
此外,在许多电解质溶液中,是通过增加酸或盐的浓度来提高溶液的导电性和减小电泳的影响。 因此,扩散层内的传质就是它的名字上的含义,是受扩散支配的。
为简单起见,让我们考虑一个金属离子Mn+ 被还原成金属M的阴极电沉积反应(式42)。
(42)
在前面所述的电极反应理论中,是假设金属离子对电极表面的供应是充分的。 然而,实际上如果将过电位η,向负方向改变,使电极反应速度增加的话,反应物金属离子的供应就会出现延迟。使得电极表面上的金属离子浓度Cx=0,低于溶液的本体浓度C°。
此时,具有δ厚度的扩散层中的金属离子 浓度如图11所示,一般分成在扩散层中的线性变化和对流层中的平滑变化。
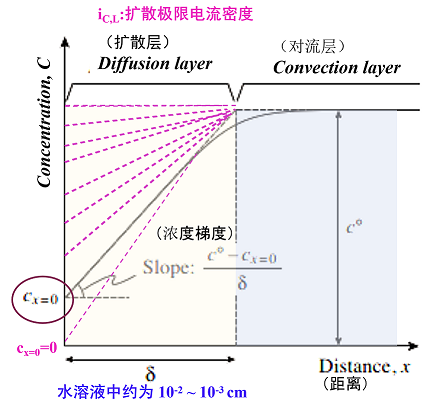
图11. 化学物质(体积浓度C°mol/L)在电极反应中被消耗时,在电极附近的有关化学物质的浓度分布和扩散层(厚度δ)的状态.
如果将一个线性近似的浓度梯度,代入扩散电流的菲克定律,电沉积引起的阴极电流密度ic可以表示为式43。式中的JD称为扩散通量,是在单位时间内跨越单位横截面的物质量(摩尔),将其乘以nF,可以转换为电流密度。 从式43中可以看出,最大的浓度梯度发生在cx=0=0时,此时扩散通量,也就是电流密度达到最大。这个电流密度被称为扩散极限电流密度ic,L,它是实际电解中η(负向)增加时,流动的阴极电流密度的上限。

(43)
扩散极限电流用式44表示。

(44)
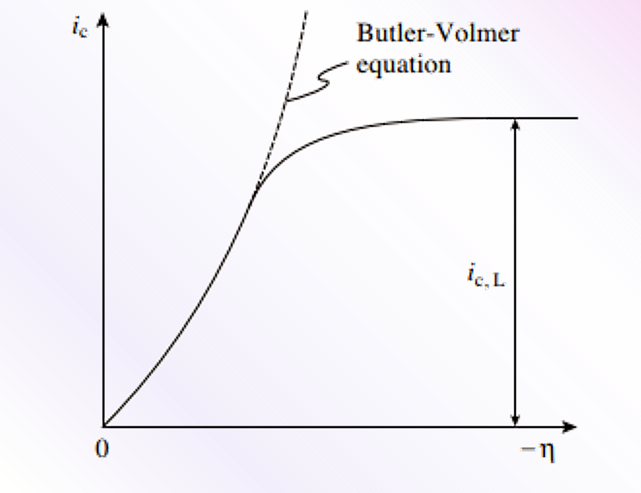
图 12 过电位向负方向变大,阴极电流达到扩散极限电流时的情况。
图 12 的阴极极化曲线中,如果将 η 向(负)逐渐增加时,Cx= 0 逐渐减小,在电流密度变为平台时,达到了阴极扩散极限电流密度 ic。
对于阳极电流密度ia 和它的极限电流密度 ia,可以做出完全相同的论证。
对于前面讨论的氧化还原反应,将传质影响加入Butler-Volmer方程后,极化曲线可以表示成式45。

(45)
