第四篇 溶剂的给体,受体性质和溶剂分类
溶剂的电子(对)给体性和受体性,可以和相对介电常数一起,成为溶液中发生的许多反应和平衡的主要影响因素。 特别是,当比较电极反应中使用的相对介电常数大的各种溶剂的溶质行为时,溶剂的给体性和受体性差异的影响,会比相对介电常数差异的影响更为显著。
作为溶剂给体性和受体性强弱的衡量标准,由Gutmann倡导的给体数(Donor number 用DN表示)和受体数(Acceptor number,用AN表示)被广泛使用[4][5].
给体数的测量方法是, 在弱给体的二氯乙烷中,样品溶剂(给体)(Body) 与 SbCl5 (强受体、较强的路易斯酸) 发生如方程式 (6) 所示的加成反应时生成产物的热量为给体数。DN值越大代表溶剂的给体性越强。
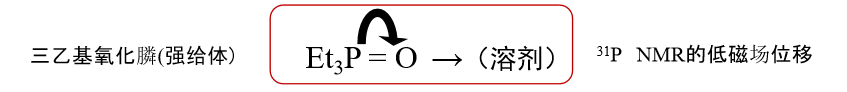
另一方面,受体数是受体性强弱的衡量标准,受体数的测量方法是。如果样品溶剂(受体)中溶解的三乙基氧化膦与溶剂间存在这样的相互作用,在此情况下,用 n-己烷作为参考,测量磷31的 NMR 低磁场位移 δ ,将 n-己烷中的受体数AN视为0,在二氯乙烷中五氯化锑与 三乙基氧化膦 间的相互作用时的受体数AN(Acceptor number)用100表示。
溶剂的受体数AN可用(7)式计算得到。 AN值越大说明溶剂的(电子)受体性越强。
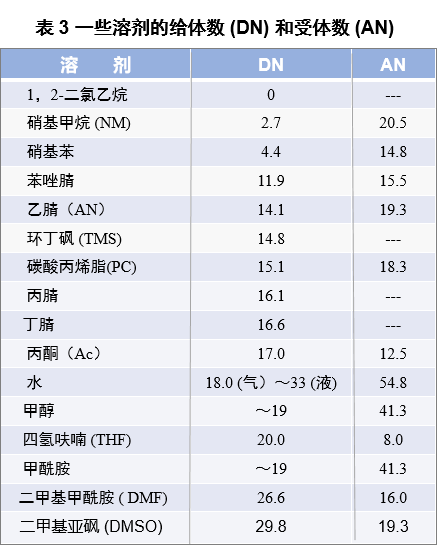

表 3 是按给体数增加的顺序列出了一些溶剂的给体数 和受体数。给体数 和受体数 是溶剂作为路易斯碱, 路易斯酸分别与五氯化锑 , 三乙基氧化膦 的相互作用的强度,它们也分别与布朗斯特碱,酸的强度密切相关。DN较大的溶剂(其质子接受性、氢键接受性较强)即碱性较强,AN较大的溶剂(其给质子性、给氢键性较强)即酸性较强。但是,溶剂的给体数和受体数与相对介电常数之间几乎没有什么关联性。
溶剂通常从布朗斯特酸碱, 即失去或得到质子的角度进行分类。表 4 是Kolthoff 教授的溶剂分类的例子 。 两性溶剂是指溶剂分子同时具有酸性和碱性。如果把溶剂用 SH 表示时,溶剂分子可释放出质子,可亦可这样接受质子。在两性溶剂中,那些酸性和碱性强度与水相近的溶剂为中性溶剂。
比水的酸性强得多,碱性要弱得多的溶剂比如硫酸,氢氟酸,甲酸,醋酸等是给质子性溶剂。相反比水的酸性弱,碱性要强得多的溶剂,比如乙二胺、NH3、甲酰胺等为亲质子性溶剂。
另一方面,非质子溶剂一般只有与碳原子键合的氢原子,因此释放质子和提供氢键的性质很弱。但是对于碱性则有强弱之分。强碱性是亲质子性的,而弱碱性则是疏质子性的。 非质子性溶剂中,偶极矩和相对介电常数较大的溶剂是极性非质子溶剂(Dipolar aprotic solvent),通常用于电极反应。
这是因为质子和氢键在这些溶剂中几乎不参与反应,这使得许多在质子溶剂(如水)中不可能出现的现象成为可能。在极性非质子溶剂中,AN、PC、TMS、NM等是疏质子性溶剂,对质子的亲和力很小,而DMF、等的这些溶剂则是亲质子性溶剂。乙腈(AN) 碳酸丙烯脂(PC) 环丁砜 (TMS) 硝基甲烷 (NM)。
在溶剂的碱性(给电子)起重要作用的反应中,这两组溶剂表现出明显不同的性质,因此需要根据目的适当选用。
参考文献
[4] V.Gutmann,“The Donor-Acceptor Approach to Molecular Interactions”,(1978),Plenum Press.
[5] V.Gutmann,Electrochim. Acta, 21,661(1976).
[6] I. M.Kolthoff,Anal.Chem.46,1992(1974)
[7] I. M.Kolthoff and P. J.Elving,ed.,“Treatise on Analytical Chemistry,”2nd ed.,Part I,Volume 2 (1979).
溶剂通常从布朗斯特酸碱, 即失去或得到质子的角度进行分类。表 4 是Kolthoff 教授的溶剂分类的例子 。 两性溶剂是指溶剂分子同时具有酸性和碱性。如果把溶剂用 SH 表示时,溶剂分子可释放出质子,可亦可这样接受质子。在两性溶剂中,那些酸性和碱性强度与水相近的溶剂为中性溶剂。
比水的酸性强得多,碱性要弱得多的溶剂比如硫酸,氢氟酸,甲酸,醋酸等是给质子性溶剂。相反比水的酸性弱,碱性要强得多的溶剂,比如乙二胺、NH3、甲酰胺等为亲质子性溶剂。
另一方面,非质子溶剂一般只有与碳原子键合的氢原子,因此释放质子和提供氢键的性质很弱。但是对于碱性则有强弱之分。强碱性是亲质子性的,而弱碱性则是疏质子性的。 非质子性溶剂中,偶极矩和相对介电常数较大的溶剂是极性非质子溶剂(Dipolar aprotic solvent),通常用于电极反应。
这是因为质子和氢键在这些溶剂中几乎不参与反应,这使得许多在质子溶剂(如水)中不可能出现的现象成为可能。在极性非质子溶剂中,AN、PC、TMS、NM等是疏质子性溶剂,对质子的亲和力很小,而DMF、等的这些溶剂则是亲质子性溶剂。乙腈(AN) 碳酸丙烯脂(PC) 环丁砜 (TMS) 硝基甲烷 (NM)。
在溶剂的碱性(给电子)起重要作用的反应中,这两组溶剂表现出明显不同的性质,因此需要根据目的适当选用。
参考文献
[4] V.Gutmann,“The Donor-Acceptor Approach to Molecular Interactions”,(1978),Plenum Press.
[5] V.Gutmann,Electrochim. Acta, 21,661(1976).
[6] I. M.Kolthoff,Anal.Chem.46,1992(1974)
[7] I. M.Kolthoff and P. J.Elving,ed.,“Treatise on Analytical Chemistry,”2nd ed.,Part I,Volume 2 (1979).
