第五篇 影响离子溶剂化的因素(上)
离子的溶剂化涉及到离子-溶剂相互作用的多种因素,它们相互关联。 这些因素包括
1) 用布朗方程表示的静电相互作用
2) 给体-受体间的相互作用
3) 通过溶剂提供的氢键与阴离子的相互作用
4) 作为硬酸碱和软酸碱的相互作用
5) d10 阳离子的电子回馈给溶剂分子的相互作用
6) 因溶剂的结构形成和结构破坏而产生的相互作用。
静电相互作用产生的能量占总溶剂化能的很大部分,但在比较 常用的相对介电常数较大的溶剂的 溶剂化能时,其他因素的影响往往更大。
a) 阳离子的溶剂化作用一般与溶剂的给体性DN(碱性)密切相关
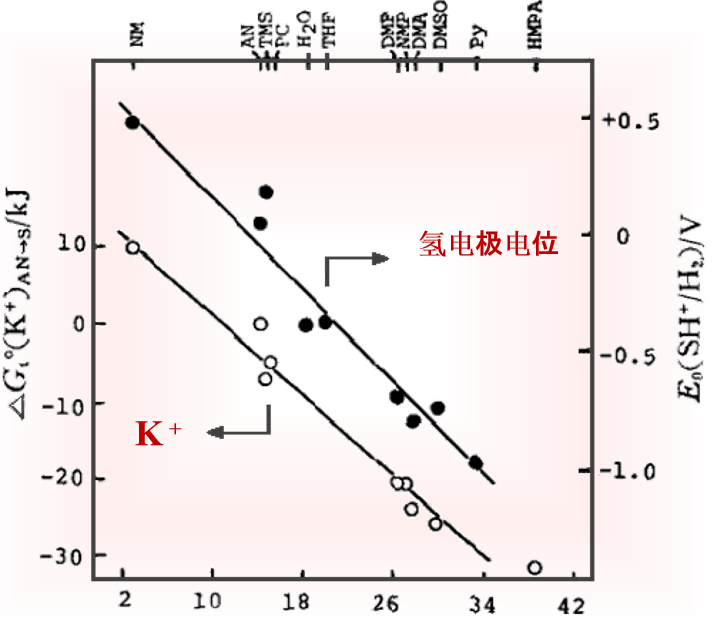
图 2 K+离子从 乙腈溶剂转移到其他溶剂的自由能(△Gt0(K+)AN→S)(〇), 以及各种溶剂中的氢电极电位(与H+离子的溶解能有线性关系)(●)随溶剂给体数DN 的变化[8.9 ].
通常阳离子的溶剂化作用与溶剂的给体性(碱性)密切相关,在DN较大的溶剂中,溶剂化作用往往较强。例如,图2 为K +离子从 乙腈转移到其他溶剂的自由能(△Gt0(K+)AN→S)(〇),随溶剂给体数DN 的变化, 以及各种溶剂中的氢电极电位(与H+离子的溶解能有线性关系)(●)随溶剂给体数DN 的变化
可以看到K +离子的溶剂化能,以及与H+离子的溶解能有线性关系的氢电极电位,二者均与溶剂的给体数DN之间存在一个近乎线性的关系。
b) 阴离子溶剂化作用与溶剂的受体性AN(酸度)密切相关
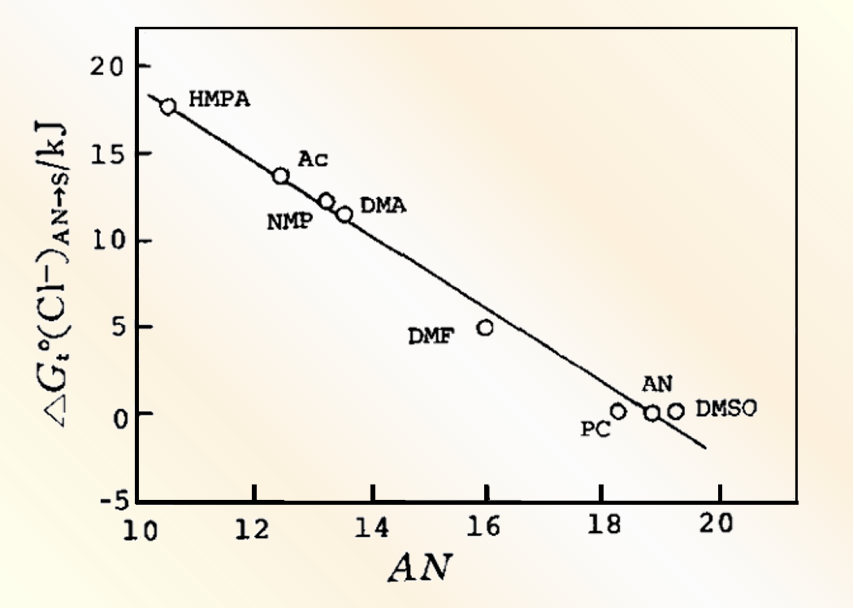
图3 Cl-离子从乙腈溶剂转移至其它非质子溶剂时的溶剂化能((△Gt0(Cl-)→S),随受体数(AN)的线性变化[8.9 ]
阴离子溶剂化作用,则与溶剂的受体性(即酸性)密切相关,溶剂的受体数AN越大,其对阴离子溶剂化作用越强。通常,氟离子、氯离子和氢氧根离子等小阴离子,以及醋酸根等,负电荷集中在较小的氧原子上的阴离子,具有很强的氢键可接受性,因此它们在水或醇中有较强的溶剂化作用。但这些离子在不能提供氢键的非质子溶剂中,溶剂化作用较弱,处于相当高的反应状态(注意表5中非质子溶剂中的Cl-的ΔGtO)
而对于一些大阴离子,比如碘离子和高氯酸根离子,一方面会因为其氢键接受的能力较弱,在水和醇溶剂中的溶解性变弱,但在另一方面,由于这些离子的极性较强,与具有类似极性的非质子性溶剂间分散力作用则会变强。这就是为何高氯酸根离子在水和醇中的溶剂化能和非质子溶剂中的溶剂化能没有太大的区别原因。
参考文献
[8] V.Gutmann,“The Donor-Acceptor Approach to Molecular Interactions”, (1978),Plenum Press.
[9] U.Mayer,Monatsh. Chem.108,1479 (1977).
而对于一些大阴离子,比如碘离子和高氯酸根离子,一方面会因为其氢键接受的能力较弱,在水和醇溶剂中的溶解性变弱,但在另一方面,由于这些离子的极性较强,与具有类似极性的非质子性溶剂间分散力作用则会变强。这就是为何高氯酸根离子在水和醇中的溶剂化能和非质子溶剂中的溶剂化能没有太大的区别原因。
参考文献
[8] V.Gutmann,“The Donor-Acceptor Approach to Molecular Interactions”, (1978),Plenum Press.
[9] U.Mayer,Monatsh. Chem.108,1479 (1977).
