第八篇 有机溶剂中的酸碱平衡和pH值范围(下)
在极性有机溶剂中,就像在水溶液中一样,可以通过将弱酸HA与其共轭碱A-(使用具有高溶解度的四烷基铵盐)或弱碱B与其共轭酸BH+(例如使用高氯酸盐)混合制成pH缓冲溶液。
BH+ 型的解离通常很简单,如上式所示,所以在极性有机溶剂中BH+ / B 缓冲溶液的成分和缓冲能力之间的关系与在水溶液中的关系相似。
然而,在HA-A-型缓冲溶液中,HA和A-可以同质共轭反应形成HA2-
然而,在HA-A-型缓冲溶液中,HA和A-可以同质共轭反应形成HA2-
共轭反应: HA + A- ⇆ HA2-
共轭反应常数: KfHA2- = [HA2-] /([HA] [A-])
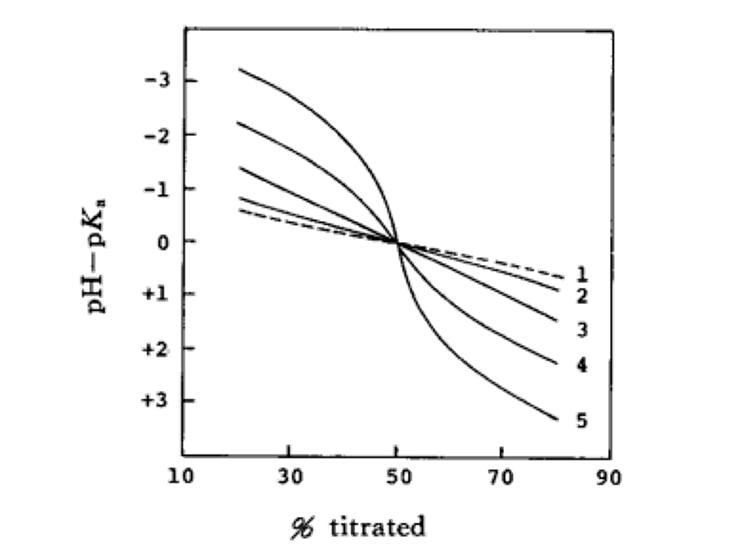
图5 同质共轭反应对用Et4NOH滴定HA酸的滴定曲线的影响)
CHAKf HA2-:1) 0(无同质共轭的情况下); 2)1; 3)10; 4)102; 5)103
如图5为同质共轭反应对用 四乙基氢氧化铵(Et4NOH)滴定HA型酸的滴定曲线的影响。无同质共轭反应作用时的滴定曲线为一条直线,随着共轭反应常数Kf的增加,滴定曲线偏离直线的程度就会变得越大。
HA-A-型缓冲溶液的组成和缓冲能力之间的关系比较复杂,当HA和A-的溶解度都比较低、反应性比较强时,就会发生同质化共轭反应。
在前面的表4中, 溶剂被分为两性和非质子性的两大类。如果我们用SH表示两性溶剂,则其发生的自电离反应可表示如下。
2SH ⇆ H2S++ S-
与水的自电离反应常数Kw = [H3O+][OH-])类似 ,可以用自电离常数KSH 即这两种离子的浓度积的 大小来表示反应进行的难易程度。
对于非质子性溶剂,一般由于给质子性非常弱,很难得到对应于 S-离子的化学成分,即使能发生微弱的自电离,得到的KSH 值往往也会不太准确。水在25度时的自电离常数,即水的离子积为10-14,可用于测量的pH值范围大致为0-14。同样,根据上面得到的KSH值,各种溶剂可以测量的pH范围如图6.中所示。
对于非质子性溶剂,一般由于给质子性非常弱,很难得到对应于 S-离子的化学成分,即使能发生微弱的自电离,得到的KSH 值往往也会不太准确。水在25度时的自电离常数,即水的离子积为10-14,可用于测量的pH值范围大致为0-14。同样,根据上面得到的KSH值,各种溶剂可以测量的pH范围如图6.中所示。

图 6 各种溶剂中的 pH 值范围(基于水的值)。
( ) 内表示的是 -logrt (H +W → SH , pKSH)
pH标度都是以水溶液为基础的,每种溶剂中的最小pH值用从水向有机溶剂转移的活性系数γt(H+)w→sH来表示的话,相当于-logγt(H+)w→sH
溶剂的给体数越小,其碱性越弱,则其酸性区域就越宽。而溶剂的受体数越小,其酸性越弱,则其碱性区域就会越宽。疏质子的非质子性溶剂, 其酸性和碱性范围均有比水宽的特点,可以加以利用。
在酸性范围较宽的溶剂中的较强的酸,或在碱性范围较宽的溶剂中的较强的碱,可以不与溶剂发生反应,保持其原本的状态存在。这可用于非水溶剂滴定中强酸和强碱的混合物的差分定量,但当电极反应中使用适当的溶剂时,作为中间体或产物的强酸性(受体性)和强碱性(给体性)物质可以稳定存在,这就是使用有机溶剂进行电极反应的重要原因之一。
溶剂的给体数越小,其碱性越弱,则其酸性区域就越宽。而溶剂的受体数越小,其酸性越弱,则其碱性区域就会越宽。疏质子的非质子性溶剂, 其酸性和碱性范围均有比水宽的特点,可以加以利用。
在酸性范围较宽的溶剂中的较强的酸,或在碱性范围较宽的溶剂中的较强的碱,可以不与溶剂发生反应,保持其原本的状态存在。这可用于非水溶剂滴定中强酸和强碱的混合物的差分定量,但当电极反应中使用适当的溶剂时,作为中间体或产物的强酸性(受体性)和强碱性(给体性)物质可以稳定存在,这就是使用有机溶剂进行电极反应的重要原因之一。
