标准电极电位基础介绍连载
- 第一篇:关于氧化还原反应
- 第二篇:标准电极电位的定义
- 第三篇:标准状态和标准电极电位测量
- 第四篇:电动势和热力学量
- 第五篇:Li+/Liの標準電極電位&Nernst方程式
- 第六篇:平衡的两层含义
- 第七篇:式量电位(formal potential)
- 第八篇:总结
第一篇 回顾氧化还原反应 · 原电池和电解池
· 氧化还原反应
氧化还原反应是指发生电子得失的化学反应。
我们可以将上面的氧化还原反应拆分成以下两个半反应:
一个是还原反应,即物质1的氧化态 Ox1得电子还原成物质1的还原态Red1 。另一个是氧化反应,在此物质2的还原态Red2 失电子氧化成物质2的氧化态Ox2氧化-和-还原反应必然是成对出现,半反应是不能单独存在的。
对于发生n个电子转移的氧化还原反应可用用通式表示为2式和 3式中的还原半反应和氧化半反应。
· 原电池和电解池
我们知道原电池是通过氧化还原反应将化学能直接转变成电能的装置,而电解池则是通过电解反应,将电能直接转变成化学能的装置。
电解反应就是通过外部电源设备控制电极上的电位或电流,使在电解质溶液中的两个电极出现电位差(阳极,阴极),并分别发生氧化-还原反应的过程叫做电解。
下面通过比较图1和图2,来进一步加深我们对原电池和电解池的理解。
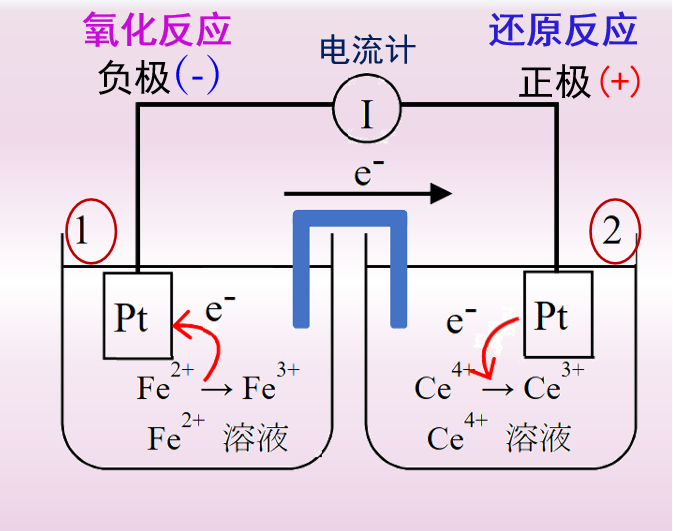
图1 原电池
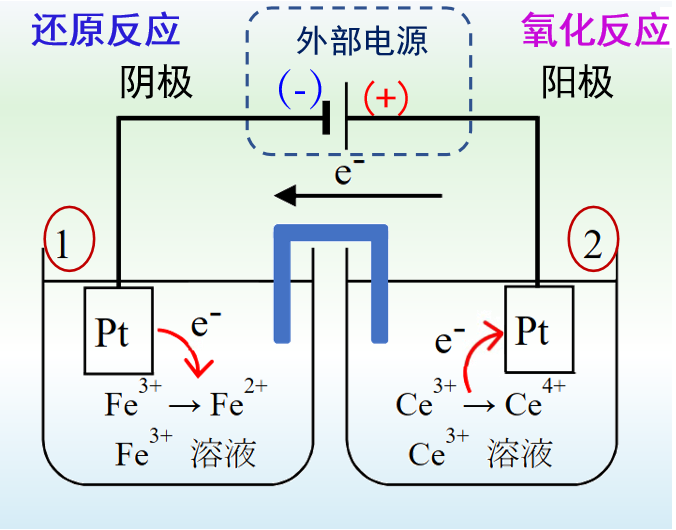
图2 电解池
对于图2中的电解池,与外部电源的正极连接的电极为阳极,在阳极上发生氧化反应,Ce3+氧化成Ce4+。与外部电源的负极相连的电极为阴极, 在阴极上发生还原反应,Fe3+离子还原生成Fe2+离子。
图1的原电池与图2的电解池中的电极反应,互为逆向反应。原电池工作过程为放电过程, 而电解池的工作过程则为充电过程
对于图1中的原电池的整体电池反应式可以用式 (4)来表示
按照约定将半电池反应,统一用还原半反应的形式来表示,那么图1的原电池反应就是由式(5)和式(6)的两个半电池反应组成。
第二篇标准电极电位的定义
通常将标准氢电极(SHE, standard hydrogen electrode ) 作为参照基准的电极 。并定义其电极电位 ESHE = 0 V 。
将ESHE 作为参比电极测得的电位差被定义为:电极电位
标准状态下的电位差定义为:标准电极电位(Eo,standarde electrode potential)
Eo Ce3+/Ce4+=1.61V →就是标准状态下 Ce4+/Ce3+ 相对于 SHE 的标准电位差(图 3)
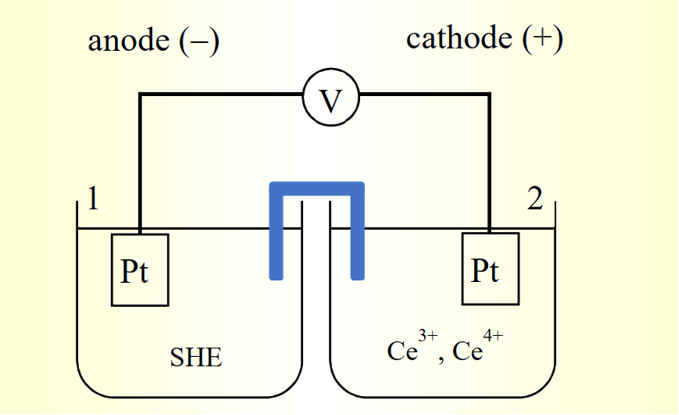
图 3. 相对于 SHE 的电位
图1的中原电池的标准电池电动势可以如下计算得到,为0.84V。
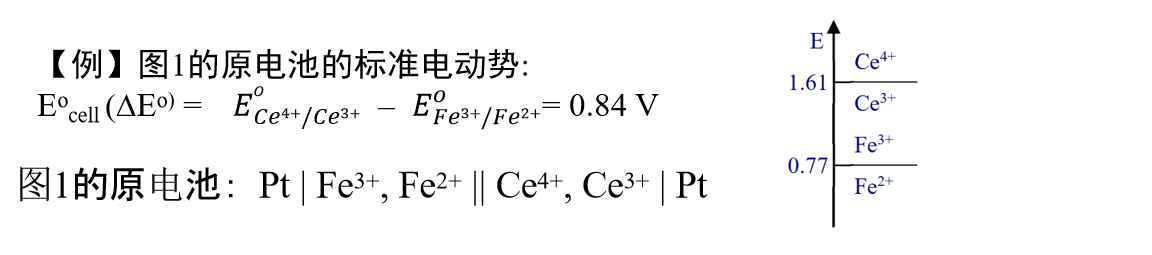
图1中的电池可以这样表示: 负极|溶液1 || 溶液2|正极 (单根竖线 |代表两相界面; 双根竖线||代表两个液相界面间的盐桥连接)
理解电极电位的正负值大小的含义,对今后设计和判断氧化还原反应进行的方向是非常有用的:
电极电位E的正值越大: 表示其氧化态物质为越强的氧化剂(氧化态物质容易被还原)
电极电位E的负值越大: 表示其还原态物质为越强的还原剂(还原态物质容易被氧化)
当两个半电池连接组成电池时,右侧为正极(还原反应),左侧为负极(氧化反应)时,电池的电动势为正。 Ecell = E 右 – E左> 0
先来考虑下面的反应式(7)的反应例。银氯化银固体得到一个电子,还原成银原子并释放出一个氯离子。
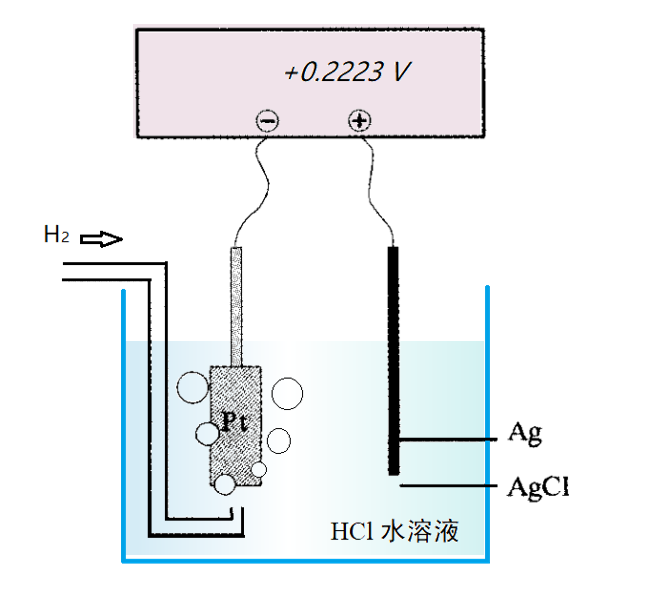
图4 Harned 电池电动势测量示意图
Eo(AgCl/Ag)=0.2223 V[1]
(11)
参考文献
[1] A.J.Bard,R Parsons,and J.Jordan,Stand Potenrials in Aqueous Solution,Marcel Dekker,New York(1985).
第三篇标准状态和标准电极电位测量
a) 何谓标准状态~
什么是标准状态呢? 这是解决问题的关键所在。其实对标准状态的选择基本上是任意的。 只是为了实用方便而被选中。
通常,单质或化合物的标准状态是指在标准压力(一个大气压)和温度(通常为25°C)下,进行实验的的纯物质。 在前面的例子中,金属银和固体氯化银为纯物质时,它们都处于标准状态。
另一方面,溶解在溶液中的物质(也就是溶质)的标准状态是指其活度为1的状态,活度是表示溶质的有效浓度(摩尔分数、质量摩尔浓度、体积摩尔浓度等)的单位。接下来,我们将使用大家熟悉的体积摩尔浓度。
一般来说,对于任意的一个化学物质A,可以用式12来表示其化学势(化学能)。
γA 为活度系数,Co为标准浓度(1 mol dm-3)
当化学物质A的浓度降低到极限时,其活度系数无限接近1。
此时,溶质之间或溶质与溶剂之间的相互作用变得可以忽略不计,接近理想状态。 标准状态就是被假设为处于这种理想状态(活度为1的状态)时的化学物种的单位浓度。
或许可能有点难以理解,但重点是,应调整溶液的浓度,使溶质的活度为1 (当然,这只有在事先知道该物质的活度系数的情况下才有可能)。
b) 如何测量标准电极电位?
这样看来,如果想要直接从电动势测量中获得标准电极电位,只要构建如下面那样的电池2,让所有反应物种都处于标准状态的电池,并测量其电动势就可以了。 Cu(s)ΙPt(s)ΙH2(g, PH2=Po)ΙH+(αq,α=1 ),Cl-(αq, α=1)ΙAgCl(s)ΙAg(s)ΙCu(s) 根据 Nernst 公式,Harned 电池的电动势:可以表示为式16
但在实际上要组装这样的电池,是非常困难的。必须要配制氢离子和氯离子的活度同时为1的盐酸水溶液,该如何配制呢? 由于无法测量单个离子的活度系数,因此需要导入平均活度系数γ± 将上述的式16变换成 式17:
将氢离子浓度等于氯离子浓度等于盐酸浓度和氢气的分压等于标准大气压恒等于1代入后,进一步变换后,得到式18.
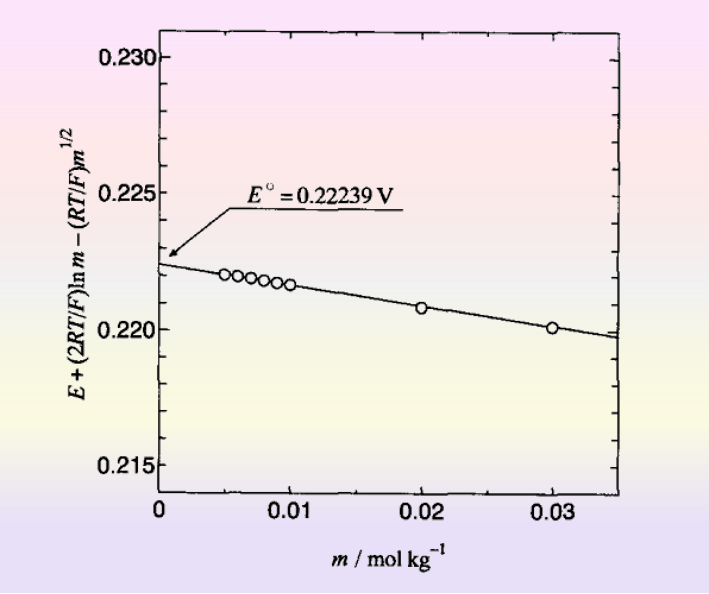
图5 从无限稀释时的电动势得到标准电极电位[2]
这样看来,似乎可以通过测量无限稀释时的电动势,来得到各种物质的标准电极电位。 但是,这种方法并不能用于所有的情况(可以测量的体系非常少)。 例如,目标反应的反应速度很慢(因为对测量平衡电位这是一个问题),发生副反应,形成表面膜等等。在大多数情况下无法实际测量。 即使在这种情况下,标准电极电位还可以通过完全不同的方法获得。 换句话说,就是一种使用热力学关系的方法。
参考文献
[2] H.S.Harned and R.W.Ehlers,J. Am. Chem. Soc., 54 (1932)1350.
[3] R G.Bates and J. B. Macaskill,Pure and Appl. Chem.,50(1978)1703.
第四篇电动势和热力学量
众所周知,电动势与化学反应的吉布斯自由能之间存在如下(式19)关系。
其中,n 为反应电子数,同样,标准电动势 Eo也与标准吉布斯自由能 ΔGo之间存在着相同的关系。如果可以通过某种方法计算反应的ΔGo,则可以得到Eo。 另一方面,标准吉布斯自由能 ΔGo 与标准焓 ΔHo 和标准熵 ΔSo 之存在式 (20) 的关系。
可以利用该关系来计算 Eo。 事实上,大多数物质的 Eo就是从这种热力学关系中得到的数值。 但是,在溶液反应中经常会有离子出现。 因此,计算时必须要有离子的热力学参数(标准生成焓和标准生成熵)。
例如,银氯化银溶解产生银离子和氯离子时的离子生成能可以从反应式21中的溶解平衡常数来计算。
如果可以通过实验确定上述反应的产物浓度,那么∆Go可以用下面的22式计算。
然而,对于式21,不可能通过实验来研究单个正离子或负离子的特性。 各个离子的热力学参数仍然必须相对于一些参考标准来表达。 这里就是氢气的反应再次出现的地方。
比如上面这样一个反应(式23),金属铝单质的标准状态反应生成形成3价铝离子时,溶液中的氢离子被还原成标准状态的气体氢分子,整个体系保持电中性。 按照约定将标准状态下单体的焓和吉布斯自由能定义为零,式(23)中的反应在25°C时的标准焓变和标准吉布斯自由能变化可以用式(24)和(25)表示。
那么对于,电荷数为zA的离子A,其标准生成焓和吉布斯自由能可以用式(26)和(27)表示。 此外,标准熵也可以用同样的方式表表示。 然而,与标准焓和标准自由能不同之处,标准熵是指在是绝对零度(0 K)时的熵值。
因此,离子A的标准(生成)熵用式(28)表示。
其中" ‘ "是指绝对熵。 利用这一点,像式(23)这样的反应的标准熵值变化,一般可以表示为方程(29)。
其中SoA ‚ element是指单质A在25°C时的熵。经常使用的 "假设氢离子的焓、熵和吉布斯自由能为零 "这一表述的基础就是以上述定义为根据的。 计算所需的各种热力学量值可以从收集到的数据中获得。 还有一个数据库,它有几个不同的特点。 详情请见参考资料4。
参考文献
[4]电化学便览(第五版),日本电化学学会,丸善(2000),第87页。
第五篇 Li+/Liの標準電極電位&Nernst方程式
◆Li+/Liの標準電極電位
在水溶液中的氧化态和还原态都很稳定的氧化还原反应中,有可能直接使用氢电极测量电位,但对于不稳定的物质,就不能这样测量了。 例如,如果我们想测量Li+/Li的电位,金属锂在水中是不稳定的,因为它在生成氢气的同时迅速溶解,即使它是稳定的,也不可能测量它,因为会先发生溶剂分解反应。 此时就是热力学关系发挥作用的地方:可以根据溶液I的自由能的测量值,用Latimer法确定溶液 I 的自由能。
根据溶解的自由能测量,Latimer计算出Li+/Li的标准电极电位为-3.045V[5]。
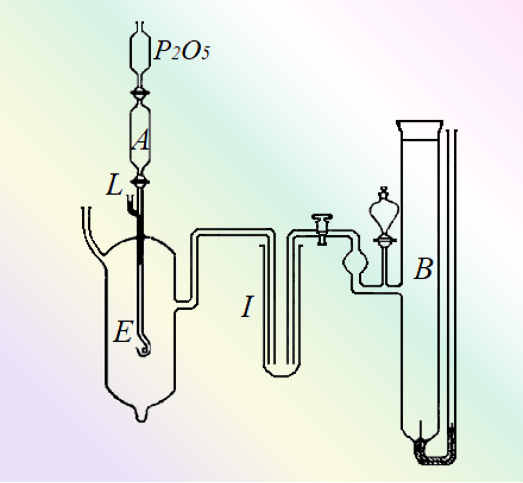
LEFT:图6. 用于测量Li汞齐电极的电动势的装置示意图[6]。
汞合金从A中的储存器通过毛细管进入电解质(KOH水溶液),作为工作电极(E)。B是一个甘汞电极,I 中充满了氯化钾溶液。
我们可以用这样的通式(式30)来表示任意的一个还原半反应,该半反应的能斯特反应式表示为式31。
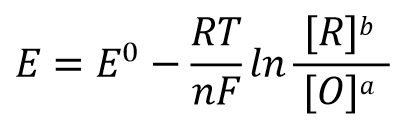
根据反应达平衡时的电动势 E=0 以及式32中的反应平衡常数 K的表示形式,式31可以改写成式33, 经过移项后 可以得到式34这样的关系式。
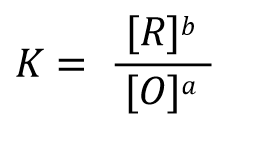
(32)
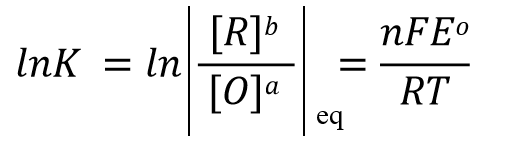
(34)
参考文献
[4] Encyclopedia of electrochemistry of the elements (Ed. A. J. Bard), Vols.1-14, Marcel Dekker, New York (1973-1986).
[5] G. N. Lewis and F. G. Keyes, J. Am. Chem. Soc., 35 (1913) 340.
[6] G. N. Lewis and F. G. Keyes, J. Am. Chem. Soc.,354(1912)119.
第六篇平衡的两层含义
(1) 平衡电位(equilibrium potential)
关于平衡,的第一层含义是指平衡电位(equilibrium potential):即,各个半电池处于平衡状态时的电位差。
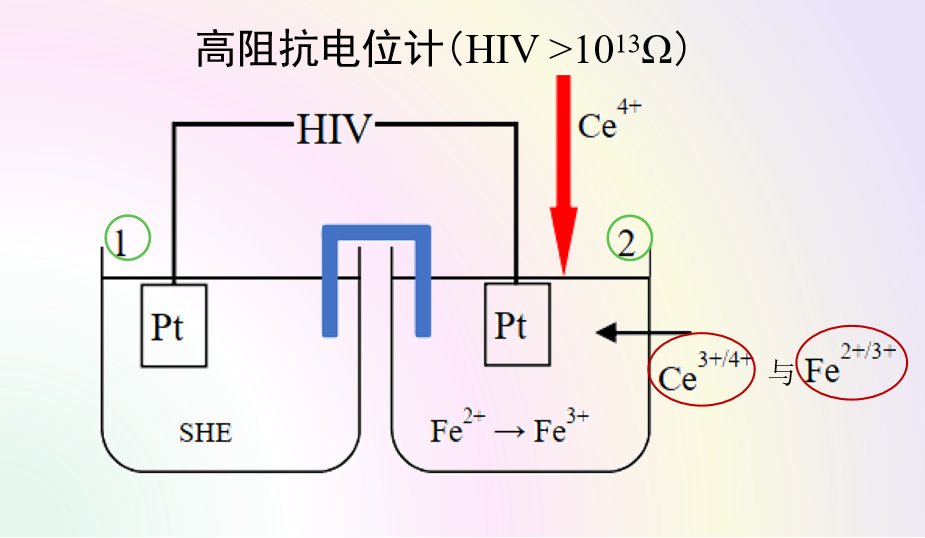
图7. Fe2+与Ce4+的电位差滴定。
(2) 电池电压的平衡
平衡的第二层的含义是电池电压的平衡。
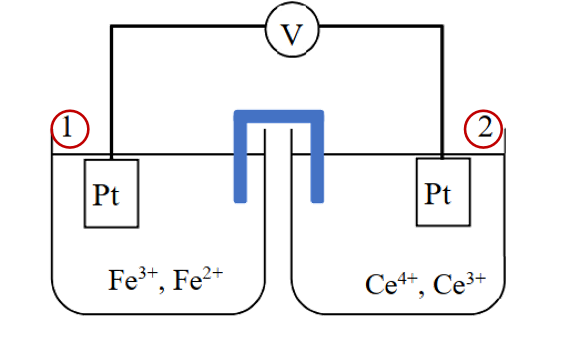
图8 电池的电压。
半电池1的Nernst公式:
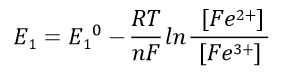
(39)
半电池2的Nernst公式:
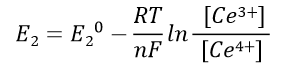
(40)
反应前的电池电动势:
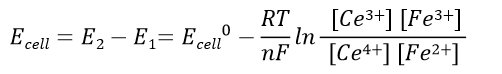
(41)
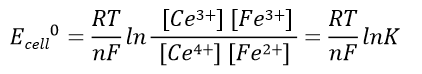
(42)
第七篇式量电位(formal potential)
在热力学标准状态下,活度 αH+= 1 ([H+] = 1 mol dm-3, pH = 0) 是电位的参考标准。在生物化学中, 通常把pH = 7 作为标准。
a) 电位随溶液pH值而变化的体系
在此以氢电极(式43)为例。
对于上述的电极反应,其Nernst方程可以写成式44
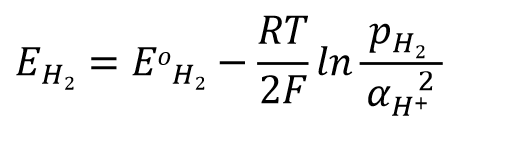
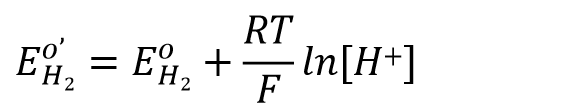
b)配合物形成的体系
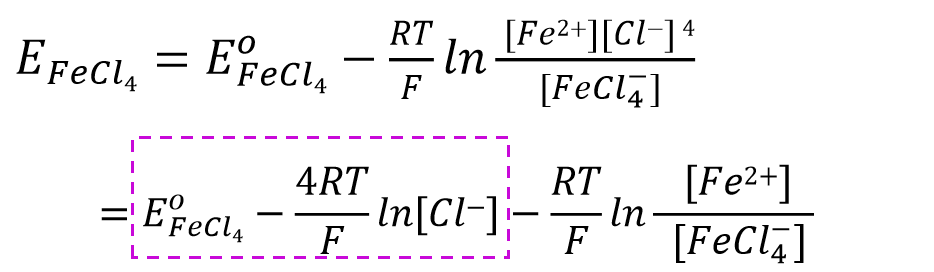
再来看一下络合物形成的体系。比如对于这样一个,3价铁离子的4氯合铁配离子得到一个电子还原成二价铁离子并放出4个氯离子的还原反应(式47)
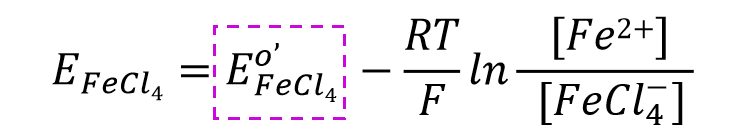

比如3价铁离子与氯离子形成4氯合铁配离子的反应(式51), 配合物生成反应平衡常数可表示为式52
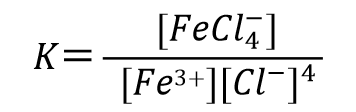
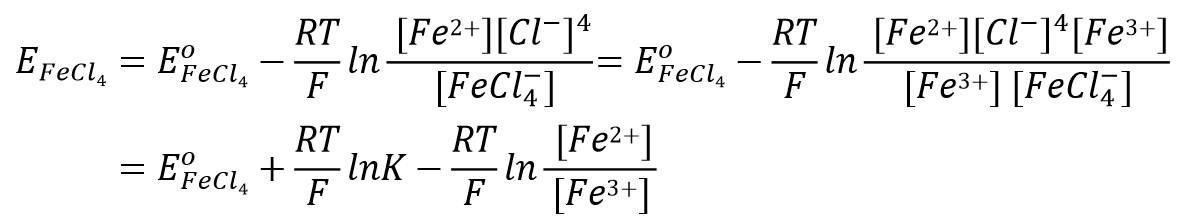
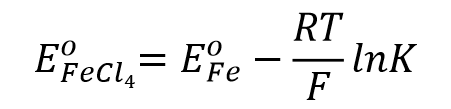
第八篇 总结
◆氧化还原反应:发生电子得失的化学反应
◆原电池和电解池:原电池是用过氧化还原反应将化学能转化为电能的装置;电解池则通过电解反应将电能直接转变成化学能的装置。
◆标准电极电位
・标准电极电位的定义:在标准状态下氧化/还原电对(半电极)相对于 SHE 的标准电位差。
・何谓标准状态:在标准压力(Po=105Pa)和进行实验的温度(通常为25°C)下的纯物质(单质或化合物)。
・如何测量标准电极电位:通过组成Harned电池,并根据在无限稀释状态下γA→1,通过各种方式改变盐酸浓度CHCl,测得每次的电动势E,将电动势外推至HCl→0时, 得到的E为标准电极电位Eo。
・电动势和热力学量 :利用电动势E= - ∆G/nF 以及 ∆Go = ∆Ho - T∆So 的关系式,用热力学方法计算Eo。
・ Li+/Liの標準電極電位:
①测量溶解的自由能,用热力学方法计算出Li+/Li的标准电极电位为-3.045V。
②间接法测量:首先测量金属锂和锂汞合金电极在脱水的丙胺中的电势,然后测量了锂汞合金电极和甘汞电极在水溶液中的电势,得到甘汞电极的Li+/Li的标准电位为-3.3044V。
◆Nernst方程式:平衡的两层含义- 平衡电位(equilibrium potential); 电池电压的平衡。
◆式量电位:电位随溶液pH值而变化的体系的式量电位在恒定pH值下为定值; 络合物形成的体系的式量电位取决于配位反应的平衡常数,其为定值。
(完)
