第五篇 Li+/Liの標準電極電位&Nernst方程式
◆Li+/Liの標準電極電位
在水溶液中的氧化态和还原态都很稳定的氧化还原反应中,有可能直接使用氢电极测量电位,但对于不稳定的物质,就不能这样测量了。 例如,如果我们想测量Li+/Li的电位,金属锂在水中是不稳定的,因为它在生成氢气的同时迅速溶解,即使它是稳定的,也不可能测量它,因为会先发生溶剂分解反应。 此时就是热力学关系发挥作用的地方:可以根据溶液I的自由能的测量值,用Latimer法确定溶液 I 的自由能。
根据溶解的自由能测量,Latimer计算出Li+/Li的标准电极电位为-3.045V[5]。
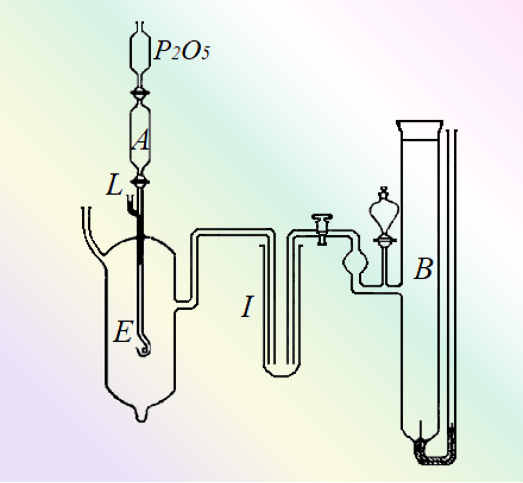
LEFT:图6. 用于测量Li汞齐电极的电动势的装置示意图[6]。
汞合金从A中的储存器通过毛细管进入电解质(KOH水溶液),作为工作电极(E)。B是一个甘汞电极,I 中充满了氯化钾溶液。
◆Nernst方程式
我们可以用这样的通式(式30)来表示任意的一个还原半反应,该半反应的能斯特反应式表示为式31。
我们可以用这样的通式(式30)来表示任意的一个还原半反应,该半反应的能斯特反应式表示为式31。
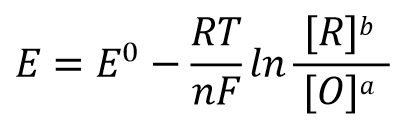
根据反应达平衡时的电动势 E=0 以及式32中的反应平衡常数 K的表示形式,式31可以改写成式33, 经过移项后 可以得到式34这样的关系式。
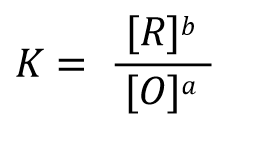
(32)
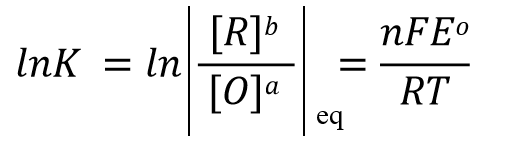
(34)
参考文献
[4] Encyclopedia of electrochemistry of the elements (Ed. A. J. Bard), Vols.1-14, Marcel Dekker, New York (1973-1986).
[5] G. N. Lewis and F. G. Keyes, J. Am. Chem. Soc., 35 (1913) 340.
[6] G. N. Lewis and F. G. Keyes, J. Am. Chem. Soc.,354(1912)119.
