电位差测量和电极介绍连载
本篇将介绍电极组成的类型,电位差测量池的类型, 电位测量用参比电极,电位测量方法及其对浓度测量的应用,以及电位测量准确性的计算方法。然后对pH测量用玻璃电极的构成和工作原理也做了简单介绍。最后为大家介绍安全实用的可逆氢电极RHE,及其在电位测量中的应用。
- 第一篇:电极组成的类型
- 第二篇:电极电位测量池的类型
- 第三篇:参比电极和电位测量
- 第四篇:参比电极和电位测量(II)
- 第五篇:pH玻璃电极的构成及原理
- 第六篇 可逆氢电极RHE及其应用
- 第七篇 电解析氢
- 第八篇 校正参比电极的电位
第一篇. 电极组成的类型
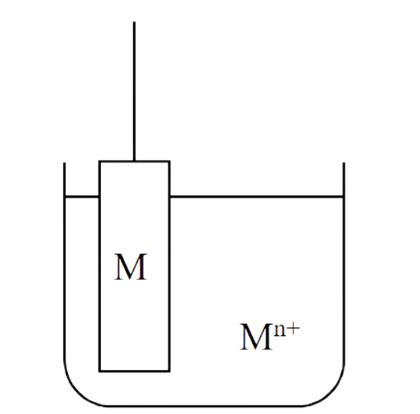
(1) 金属-金属离子电极 M | Mn+
金属-金属离子电极, 就是将金属丝(板)浸入含有同类金属离子的溶液中构成的电极(图1)。
举个最简单的例子,就是把银线浸入银离子的溶液(比如硝酸银溶液)电极反应式为银离子得到一个电子还原成银原子(式1)。
电极电位的Nernst方程可以用式2表示,电极电位和银离子浓度有关。
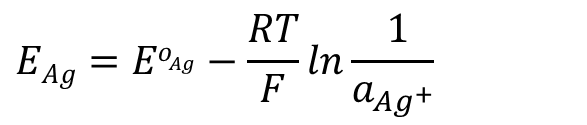
另一个大家熟悉的电极,就是将金属锌棒浸入硫酸锌溶液中,形成的金属锌与2价锌离子的电极。
电极反应可以表示为,一个2价锌离子得到2个电子,还原生成锌原子(式3)。
电极反应可以表示为,一个2价锌离子得到2个电子,还原生成锌原子(式3)。
该电极反应的Nernst方程可以表示为式4.
从上述各式可以看到,这类金属-金属离子电极的电位会随溶液中金属离子的活度的变化而变化。
(2) 金属-难溶金属盐电极 M | MX | Xn-
下面介绍第二类电极就是金属-及其难溶盐电极。
这类电极中的代表,就是我们非常熟悉的银氯化银电极。
(2) 金属-难溶金属盐电极 M | MX | Xn-
下面介绍第二类电极就是金属-及其难溶盐电极。
这类电极中的代表,就是我们非常熟悉的银氯化银电极。
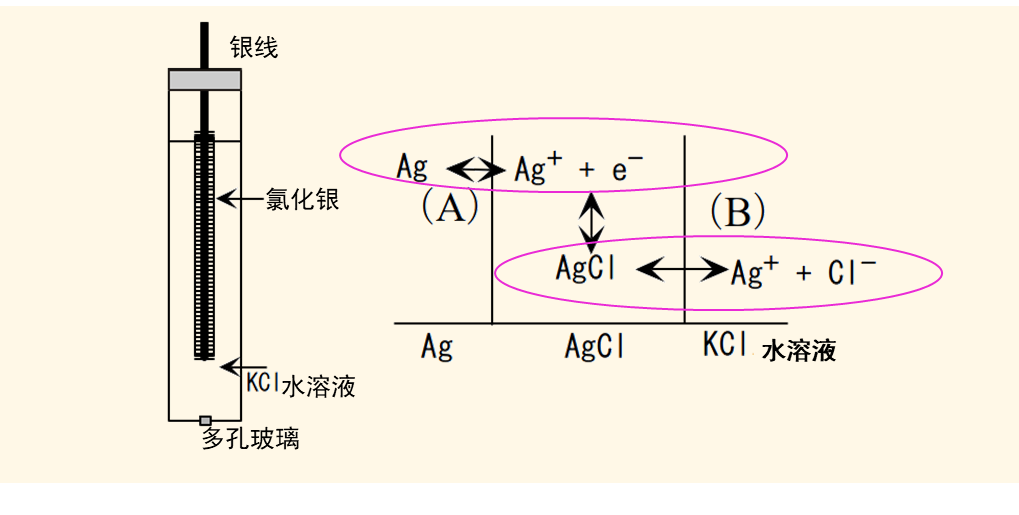
图2 Ag | AgCl 电极的构造示意图
Ag | AgCl 电极的构造如图2所示。一般是在银线上覆盖氯化银沉淀,然后浸入装有氯化钾或氯化钠溶液的玻璃管中,玻璃管的前端使用多孔玻璃或陶瓷作为液接部的材料,可以让离子可以自由出入。根据电极书写规则,电极可以这样书写:Ag | AgCl | Cl-
该电极反应式为AgCl固体得到1个电子生成银原子同时释放出一个氯离子。
该电极反应式为AgCl固体得到1个电子生成银原子同时释放出一个氯离子。
其Nernst方程式在6式中表示。这类电极的电极电位与形成沉淀的阴离子氯离子的浓度相关,电极反应包含了图2中的这些反应过程。如果增加溶液中阴离子氯离子的浓度,就可以有效抑制AgCl的溶解反应的进行,从而保持溶液中溶解的银离子的活度保持在一个恒定的值。
当上述这些反应达到平衡时,银·银离子电极的电位与银氯化银电极的电位应该相等。EAgCl =EAg, 从式(6),式(2)得到下下述关系式7。
当上述这些反应达到平衡时,银·银离子电极的电位与银氯化银电极的电位应该相等。EAgCl =EAg, 从式(6),式(2)得到下下述关系式7。
将式7进行移项变化后得到式8a,进一步将方程式中的对数项进行合并后得到8b。
根据标准电极电位数据表中记载的银银离子电极,以及银氯化银电极的标准电极电位数值EoAg = 0.7991 V,EoAgCl = 0.2222 V , 代入8b式后,计算得到银离子活度与氯离子的活度积为→ 𝑎Ag+ ・ 𝑎Cl- = 1.667×10-10 。也就是AgCl的溶度积常数为KSP =1.667×10-10 。
Ag-AgCl电极的电位是由Cl-活度大小决定。 如果Cl-的活度保持不变时(饱和溶液),电位也保持不变。 由于这类金属及其难溶盐电极,在含有其高浓度阴离子的溶液中的电位十分稳定,因而可以代替SHE作为常规的参比电极(reference electrode)使用。
(3) 氧化还原电极 Pt | Mm+, M(m-n) +
氧化还原电极通常是将铂金电极浸入金属m+价和金属(m-n)+价离子的溶液中构成的电极(图3)。
Ag-AgCl电极的电位是由Cl-活度大小决定。 如果Cl-的活度保持不变时(饱和溶液),电位也保持不变。 由于这类金属及其难溶盐电极,在含有其高浓度阴离子的溶液中的电位十分稳定,因而可以代替SHE作为常规的参比电极(reference electrode)使用。
(3) 氧化还原电极 Pt | Mm+, M(m-n) +
氧化还原电极通常是将铂金电极浸入金属m+价和金属(m-n)+价离子的溶液中构成的电极(图3)。
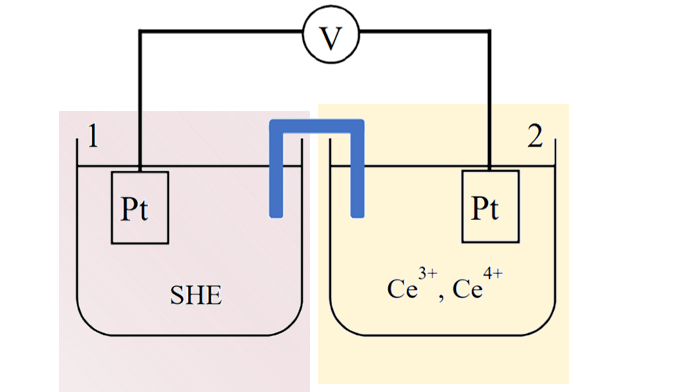
图3 Pt | Ce4+, Ce3+电极
电极反应可用式9表示, Nernst方程式可用式10表示
比如将铂金电极浸入含3价和4价柿离子的溶液中构成的氧化还原电极(式11),电极反应为Ce4+得到一个电子,还原成Ce3+。
Nernst方程式为式12, 此类电极电位取决于溶液中氧化态和还原态离子的活度比。
还有作为决定电极电位的参考标准的氢电极,也属于此类氧化还原电极: Pt(s) |H2(g) | H+ (aq)。
与上面的Ce4+ /Ce3+氧化还原电极不同的是,氢气为气相,而氢离子在液相中,书写电极时两者之间应加入一根短竖线表示存在着的相界面。
氢电极的反应式和Nernst方程式表示如下。
第二篇 电极电位测量池的类型
(1) 一室型池:无液接盐桥
电极电位是通过测量该电极与氢电极之间的电位差得到的。电极电位测量池的类型,按照是否使用盐桥可分为一室型池和二室型池。
先观察不使用盐桥的一室型池。
图4为,将氢电极和银氯化银电极插入活度为1的盐酸溶液中时构成的电池为一室型池
先观察不使用盐桥的一室型池。
图4为,将氢电极和银氯化银电极插入活度为1的盐酸溶液中时构成的电池为一室型池
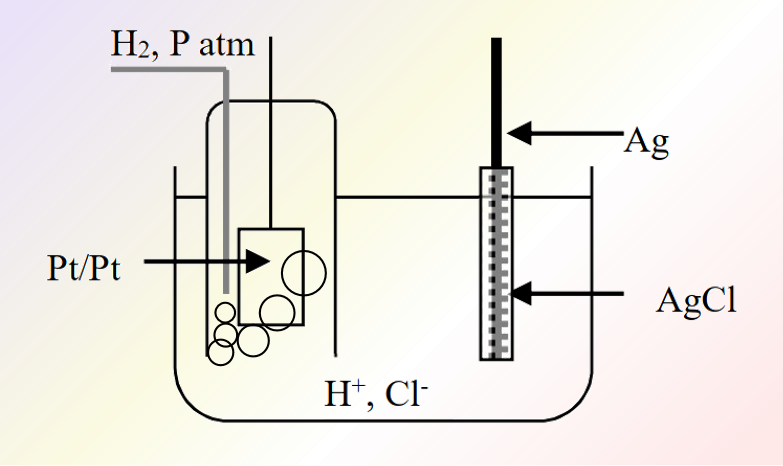
图4 氢电极-银氯化银电极
电池的构成可以从左到右,书写为:
由于被测电极与氢电极,在同一个溶液中,其没有使用盐桥,该电池电动势仅由两个半电池即两个电极间的电位差决定。
(2) 二室型池:有液接盐桥
使用盐桥进行电极电位测量的电池为二室型池。
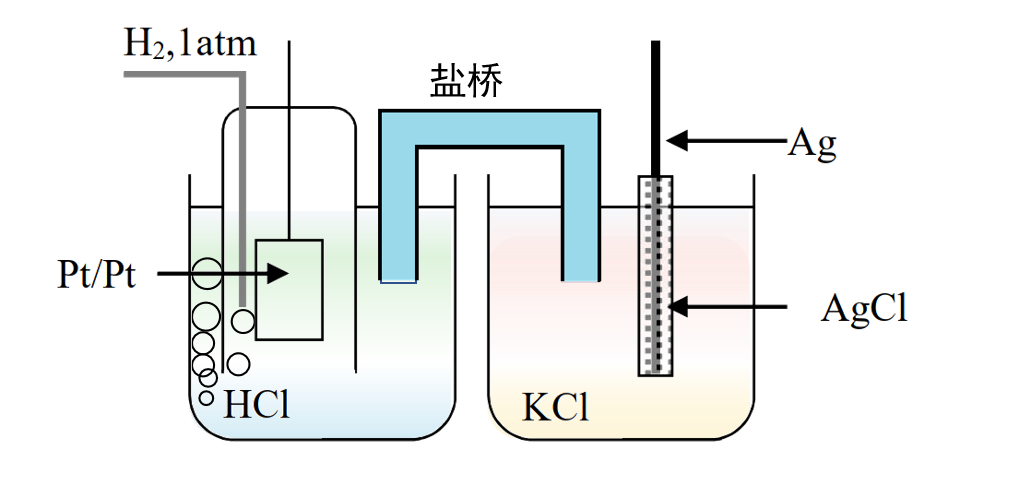
图5 氢电极-银氯化银电极溶液间用盐桥连接
如图5所示,左侧为氢气的压力为一个大气压,盐酸溶液的活度为1的标准氢电极,右侧为浸泡在活度为1的KCl的溶液中构成的银氯化银电极。两种不同的电解溶液分别在两个半电池中,溶液间使用盐桥进行连接,这样构成的电位测量池, 为二室型池。
该电池可以用16a式表示。
该电池可以用16a式表示。
在盐桥中,阳离子和阴离子携带电流,但如果阴阳离子的运动速度不同,离子会偏向液体的边界,并产生一个电位:液接电位(Ej)
此时电池的电动势表示为式16b,除了两个电极间的电位差还要加入两个半电池间的液接电位Ej。
此时电池的电动势表示为式16b,除了两个电极间的电位差还要加入两个半电池间的液接电位Ej。
两种电解质溶液间液接电位的大小取决于,界面两侧的离子的种类及其浓度的大小。
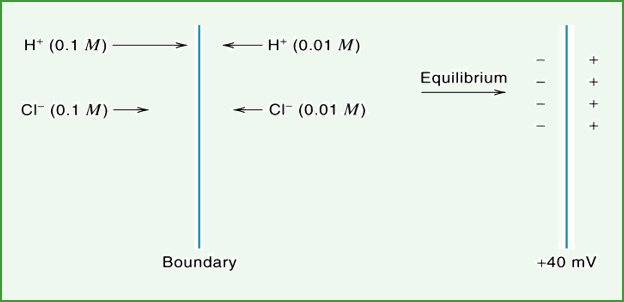
图6 不同浓度盐酸溶液的液接电位差的形成示意图
图6 为离子种类相同但浓度不同的盐酸溶液间的液接电位差的形成示意图,界面左侧的盐酸浓度较高,由于氢离子的移动速度比氯离子快, 经过一段时间达到平衡后,溶液界面的右侧出现了氢离子正电荷的集聚层,而在左侧,则出现了氯离子负电荷的集聚层,界面处形成了双电层,出现了液接电位差。

表1 列出了25°C时的一些液接电位。
・界面两侧的溶液的电解质浓度相同,但阳离子不同时: 0.1 M KCl | 0.1 M NaCl:的液接电位取决于K+ 和 Na+ 之间的离子迁移速率(即淌度)的差异。
· 界面两侧的溶液的电解质浓度不同:3.5 M KCl | 0.1 M NaCl:K+和Cl-之间的离子迁移速率(淌度)差异 (K+和Cl-承担大部分电流传导)
·界面一侧的溶液为强酸或强碱:0.1 M KCl | 0.1 M HCl 或 0.1 M KCl | 0.1 M NaOH: H+, OH-的移动速度与 K+, Cl-相比非常大 → 所以溶液间的液接电位差较大。
但是如果将左侧KCl的浓度变成3.5M时,右侧的盐酸,或氢氧化钠溶液的浓度依然还是0.1M时,液接电位会明显变小。电流的传导主要由高浓度的钾离子和氯离子承担,液接电位主要是取决于K+ 和Cl-之间的离子淌度的差。
如果要降低 Ej,应使用具有相同离子迁移速率的高浓度电解质。
・界面两侧的溶液的电解质浓度相同,但阳离子不同时: 0.1 M KCl | 0.1 M NaCl:的液接电位取决于K+ 和 Na+ 之间的离子迁移速率(即淌度)的差异。
· 界面两侧的溶液的电解质浓度不同:3.5 M KCl | 0.1 M NaCl:K+和Cl-之间的离子迁移速率(淌度)差异 (K+和Cl-承担大部分电流传导)
·界面一侧的溶液为强酸或强碱:0.1 M KCl | 0.1 M HCl 或 0.1 M KCl | 0.1 M NaOH: H+, OH-的移动速度与 K+, Cl-相比非常大 → 所以溶液间的液接电位差较大。
但是如果将左侧KCl的浓度变成3.5M时,右侧的盐酸,或氢氧化钠溶液的浓度依然还是0.1M时,液接电位会明显变小。电流的传导主要由高浓度的钾离子和氯离子承担,液接电位主要是取决于K+ 和Cl-之间的离子淌度的差。
如果要降低 Ej,应使用具有相同离子迁移速率的高浓度电解质。
第三篇 参比电极和电位测量
(1)参比电极
进行电化学测量通常需要使用参比电极。由于标准氢电极使用时需要使用氢气,存在操作环境要求并具安全隐患,通常使用具有稳定电位的电极作为常用的参比电极。
饱和甘汞电极(SCE)和 Ag | AgCl 电极,就是最有代表性的常用参比电极。银氯化银电极的电极电位的关系式,已经在前面的电极分类中的金属及其难溶盐构成的电极部分介绍过了。
甘汞电极也是属于这一类电极。是由金属汞和氯化亚汞难溶盐浸入在饱和氯化钾溶液中构成,SEC电极构成可以表示为 : Pt (or Cu)导线| Hg | Hg2Cl2(s) | KClsatd ||
由于金属汞为液态,需要与铂金线或铜线连接后,才能与外电路连接使用,所以可在左侧加上Pt (or Cu)导线的记号。
电极反应式在式17中表示. 电极电位的Nernst方程式用式18表示。
饱和甘汞电极(SCE)和 Ag | AgCl 电极,就是最有代表性的常用参比电极。银氯化银电极的电极电位的关系式,已经在前面的电极分类中的金属及其难溶盐构成的电极部分介绍过了。
甘汞电极也是属于这一类电极。是由金属汞和氯化亚汞难溶盐浸入在饱和氯化钾溶液中构成,SEC电极构成可以表示为 : Pt (or Cu)导线| Hg | Hg2Cl2(s) | KClsatd ||
由于金属汞为液态,需要与铂金线或铜线连接后,才能与外电路连接使用,所以可在左侧加上Pt (or Cu)导线的记号。
电极反应式在式17中表示. 电极电位的Nernst方程式用式18表示。
由于标准氢气电极是电位比较的最初标准,而各种常用参比电极的电位存在差异,将使用常用参比电极测得的相对电位,换算成对标准氢电极的电位后,更加方便所得电位间进行比较。
图7为 将常用参比电极测得的电位转换成vs. SHE 电位的方法 示意图。
例如,使用银氯化银电极测得的电位为0.5V, 换算方法为,将该测得值加上该银氯化银电极对标准氢电极的电位值,例如图6中的+0.228V,得到0.728V vs.SHE
图7为 将常用参比电极测得的电位转换成vs. SHE 电位的方法 示意图。
例如,使用银氯化银电极测得的电位为0.5V, 换算方法为,将该测得值加上该银氯化银电极对标准氢电极的电位值,例如图6中的+0.228V,得到0.728V vs.SHE
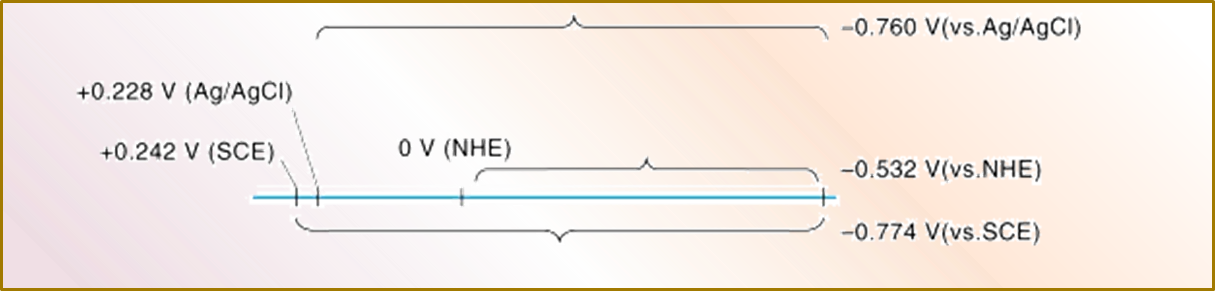
图7 将常用参比电极测得的电位转换成vs. SHE 电位的方法
(2) 电位测量

图8 电位测量装置
图8 为电位测量装置的示意图。左侧电极为参比电极,右侧电极为指示电极即电极电位会随着待测化学物种的浓度而变化的电极。
◇ 参比电极体系:电位稳定,操作方便,可代替SHE使用的电极,比如Ag | AgCl电极等。
◇指示电极体系:电极电位会随着待测化学物种的浓度而变化的电极。
[例如] 氧化还原电极(铂电极等)→ 电极电位会因溶液中氧化/还原物种的浓度比变化而改变。(Pt | Ce4+, Ce3+)
由于图8的电位测量池包含了液接电位 (Ej)。那么电池的电动势可以用式19表示(其中包含了盐桥的液接电位 Ej)。
◇ 参比电极体系:电位稳定,操作方便,可代替SHE使用的电极,比如Ag | AgCl电极等。
◇指示电极体系:电极电位会随着待测化学物种的浓度而变化的电极。
[例如] 氧化还原电极(铂电极等)→ 电极电位会因溶液中氧化/还原物种的浓度比变化而改变。(Pt | Ce4+, Ce3+)
由于图8的电位测量池包含了液接电位 (Ej)。那么电池的电动势可以用式19表示(其中包含了盐桥的液接电位 Ej)。
如果 Ej 是恒定的,无论被测样品如何(即加入了足够的支持性电解质),那么Ej可以看作是一个常数。
可以将常数项(Eref, Ej, Eoind)统合为k,因为可以用电极直接测量的不是浓度而是活度,那么电池的电动势可以用式20表示。
(20)
第四篇 参比电极和电位测量(II)
(3) 浓度测量
电位差测量法直接测量得到的是活度。在实验中,需要将其转换为浓度表示。
由于活度可以用活度系数乘以浓度来表示, 所以在离子强度相同的溶液中活度系数的值几乎是恒定的(式21).
将 logγi 并入式(20)的常数项k 后得到式22.
其中常数项 K',可以通过已知浓度的标准溶液来确定其值。
最简单的方法是, 配制相同浓度的氧化态和还原态物质的溶液,代入式22后,此时测得的电位差即为常数K'的值。
假设 Cred = Cox
测得的 Ecellc=k’ 的值
最简单的方法是, 配制相同浓度的氧化态和还原态物质的溶液,代入式22后,此时测得的电位差即为常数K'的值。
假设 Cred = Cox
测得的 Ecellc=k’ 的值
(4) 电位测量的准确性
下面我们来讨论一下电位差测量的准确性。
例如银离子得到一个电子变成银原子的电极反应(式23),其Nernst方程式为式24.
下面我们来讨论一下电位差测量的准确性。
例如银离子得到一个电子变成银原子的电极反应(式23),其Nernst方程式为式24.
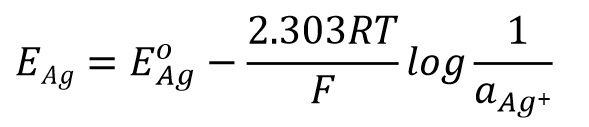
当该电极与标准氢电极构成电池,测得的电位差,也就是该电极的电极电位可用式25表示。
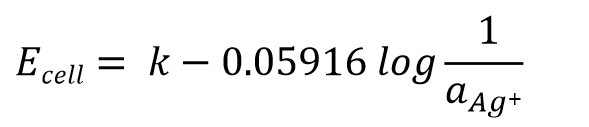
将方程式变化为式26后,进一步得到银离子活度的负对数与测量得到的电位差之间存在的关系式(式27)。
假设电位的测量误差为 1mV,计算得到银离子活度的负对数的误差为-0.017(式28)。
第五篇 pH玻璃电极的构成及原理
・pH玻璃电极的构成
pH测量常用的玻璃电极的构成在图9中表示。电极的前端为一层玻璃薄膜,内部填充了一定浓度的盐酸溶液,盐酸溶液与内部参比电极的银氯化银电极。
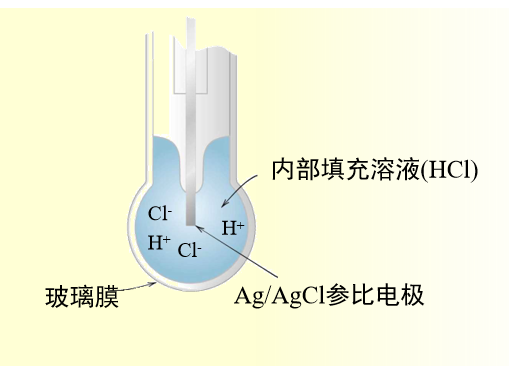
图9 玻璃电极
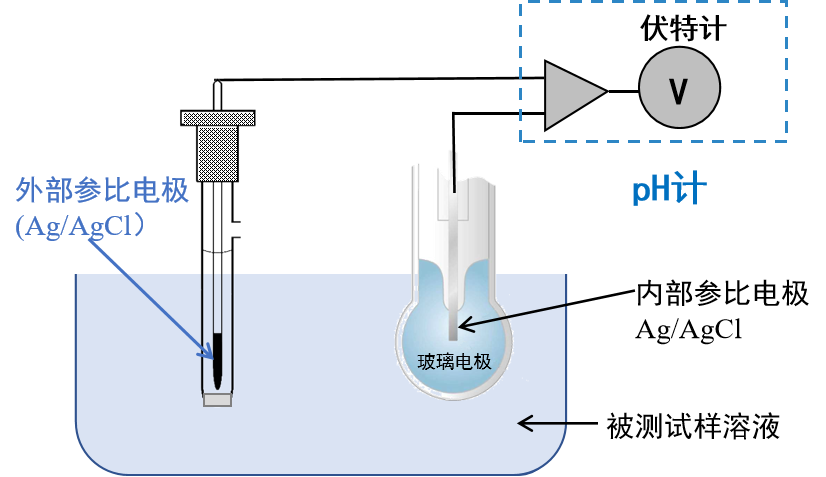
图10 pH计的基本原理
测量pH值时,玻璃电极与外部参比电极一起浸入试样溶液,并分别与pH计连接。
电池的组成可以这样书写。

从左边开始,铜导线与外部参比的银氯化银电极连接,电极插入含氢离子的试样溶液中。试样溶液与玻璃膜的外侧接触,玻璃膜的内侧与内部溶液接触,内部溶液与内部参比电极接触, 内部参比电极与铜导线连接。左右两侧的铜导线分别与pH计连接,(如图10表示)
当两种溶液隔着玻璃薄膜相互接触时,会在玻璃薄膜中产生内外两种溶液之间的氢离子浓度差,也就是 形成了与pH 差值对应的电位差。 这样就可以使用玻璃电极进行 pH 测量。
电池两极间的电位差可以用式29 表示。
当两种溶液隔着玻璃薄膜相互接触时,会在玻璃薄膜中产生内外两种溶液之间的氢离子浓度差,也就是 形成了与pH 差值对应的电位差。 这样就可以使用玻璃电极进行 pH 测量。
电池两极间的电位差可以用式29 表示。
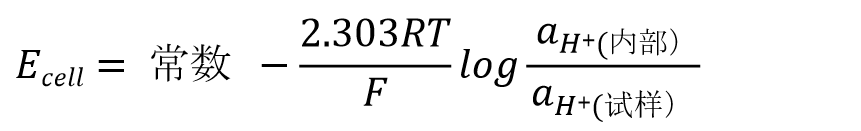
内部溶液的氢离子活度为一定值, 内部溶液活度关联的项可以与常数项合并,用K表示(式30)。
电池两极间的电位差就可以表示为式31.
将活度系数作为常数合并后,用 K’来表示
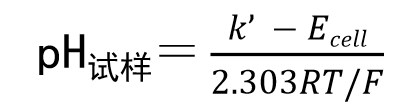
式中的 K’可以用标准溶液进行校正。
・玻璃膜电极的电位测量原理
玻璃膜电极的电位测量原理
玻璃膜:由硅酸(SiO2和氧化钠(Na2O)组成,溶液中的氢离子可以与钠离子发生这样的离子交换反应。
玻璃膜:由硅酸(SiO2和氧化钠(Na2O)组成,溶液中的氢离子可以与钠离子发生这样的离子交换反应。
基于离子交换反应的进行,电势会随H+ 的活度产生变化,但详细的机理尚未阐明。
在高碱性方向( H+ 浓度低),Na+ 和 K+ 对玻璃膜有反应 → 误差增加
在高碱性方向( H+ 浓度低),Na+ 和 K+ 对玻璃膜有反应 → 误差增加
第六篇 可逆氢电极RHE及其应用
可逆氢电极RHE
标准氢电极和可逆氢气电极均属氢电极。只是它们在构成和电极制备方法上有所不同。
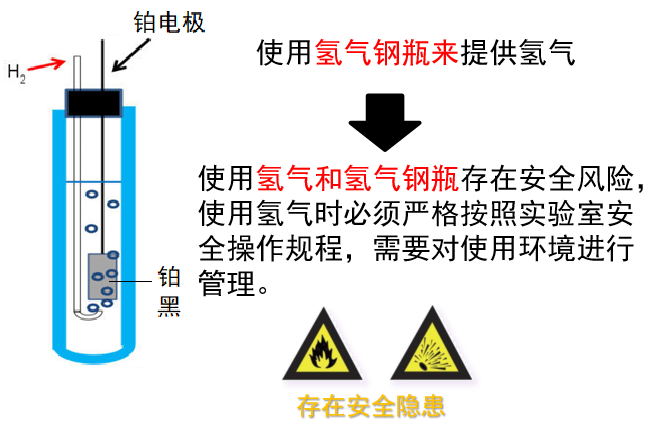
图11 标准氢电极

图12 可逆氢电极示意图
标准氢电极:工作时需要使用氢气钢瓶来不断地提供氢气,但因氢气是易燃易爆的气体,因此使用氢气和氢气钢瓶存在较高的风险。使用氢气时必须严格按照实验室安全操作规程进行,需要对实验室的操作环境进行严格的管理,使用不便(图11)。
可逆氢电极:则是通过电解酸性溶液来析出并储存氢气,制备时可以根据需要使用与被测试样溶液相同pH值的电解液,其内部溶液可以根据使用条件进行选择。 可以在任何地方使用(图12)。~ v 为了可以更方便快捷地制备可逆氢电极,我们建议使用RHEK可逆氢电极套件(图13)和H2G1便携式制氢仪(图14)。以及1.2M的盐酸,来制备可逆氢电极。
可逆氢电极:则是通过电解酸性溶液来析出并储存氢气,制备时可以根据需要使用与被测试样溶液相同pH值的电解液,其内部溶液可以根据使用条件进行选择。 可以在任何地方使用(图12)。~ v 为了可以更方便快捷地制备可逆氢电极,我们建议使用RHEK可逆氢电极套件(图13)和H2G1便携式制氢仪(图14)。以及1.2M的盐酸,来制备可逆氢电极。
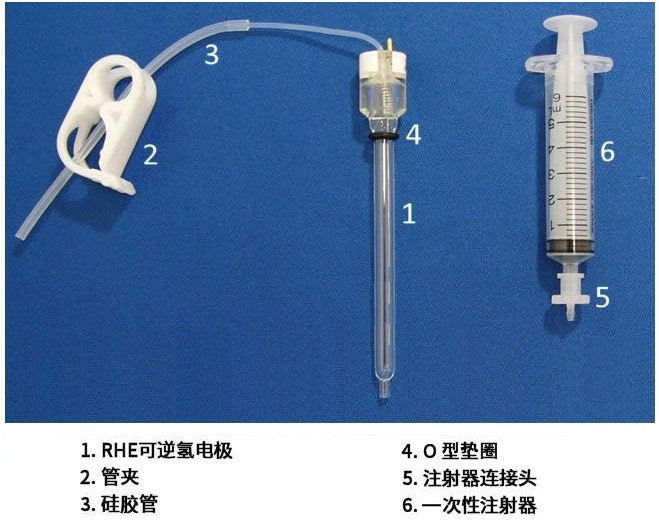
图13 可逆氢电极套件RHEK(产品编号013597)

图14 H2G1 - 便携式制氢仪 (产品编号013699)

图15 可逆氢电极RHE的制备和工作原理);
进行电解析氢操作时,只要将H2G1便携式制备氢仪的负极连线上的黑色鳄鱼夹连接到RHE电极上,将正极连线上的红色鳄鱼夹连接到对电极上。
电解时,氢离子在铂金电极上得到电子,被还原生成氢气,并存储在电极的顶部。电解完成后,电极上方的氢气压力为1大气压,氢气与溶液中的氢离子在铂金电极表面上达到平衡后,可以得到稳定的氢电极电位。如果溶液中的氢离子的活度大约为1时,RHE电极的电位约等于标准氢电极的电位,因而可以代替标准氢电极使用。
(未完待续)
电解时,氢离子在铂金电极上得到电子,被还原生成氢气,并存储在电极的顶部。电解完成后,电极上方的氢气压力为1大气压,氢气与溶液中的氢离子在铂金电极表面上达到平衡后,可以得到稳定的氢电极电位。如果溶液中的氢离子的活度大约为1时,RHE电极的电位约等于标准氢电极的电位,因而可以代替标准氢电极使用。
(未完待续)
第七篇 电解析氢
◆电解析氢前的准备







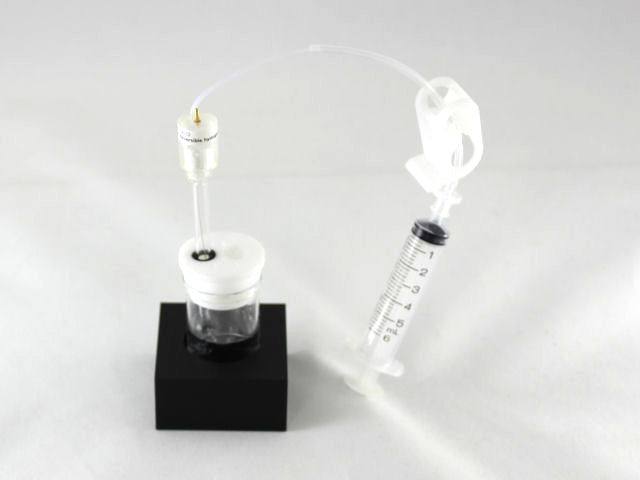



◆ H2G1的电解析氢操作
第八篇 校正参比电极的电位
◆使用H2G1测量RE-1BP vs. RHE 的电位
◆电极电位换算示例
KCl溶液在保存时容易发生晶体析出等不便,所以用3M NaCl代替饱和KCl作为内部溶液的Ag/AgCl在使用和保管上更为便利。~
常用参比电极在长期使用后由于内部溶液浓度逐渐减小,电极电位会发生漂移。使用可逆氢电极对参比电极进行电位矫正,能使得到的电化学数据更为准确。
比如,使用电位校正过的的参比电极RE-1BP循环伏安法CV测量, 得到循环伏安图,其还原峰电位为Ecp=0.193 V vs. Ag/AgCl; 氧化峰电位为Eap=0.255 V vs.Ag/AgCl。
假设用H2G1测得的银氯化银电极电位为 EAg/AgCl= 0.2023 V vs. RHE
按照下述介绍的方法将vs. Ag/AgCl的电位换算成 vs. RHE的电位。

(连载结束)