第一篇 平衡电极电位和电极反应动力学(1)
◆平衡电极电位
当一个电化学反应体系处于平衡状态,即使表面上观察不到电流的流动,这并不意味着反应已经完全停滞。 从动力学的角度来看,这是一种正向反应速度与逆向反应速度彼此相等达到动态平衡的状态。 在这种状态下,端电压(即电动势)会显示为一个定值。 这就意味着左右两边的两组电极的电位处于某个定值。 这个电势被称为平衡电极电势或简称为平衡电势。
发生在单一电极上的简单电子转移反应(式1),其平衡电势Eeq可以用电解质溶液中所含的氧化态和还原态的浓度c(严格来说是活度a)通过能斯特方程(式2)来定量表示。
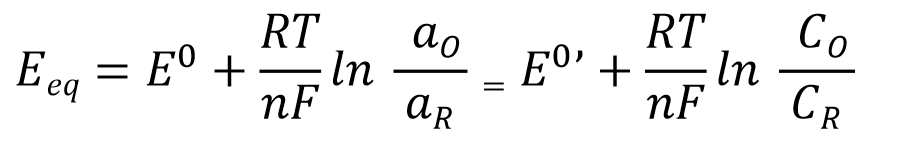
F:法拉第常数 (96485 C mol-1)
R: 理想气体常数 (8.31J K-1 mol-1)
T :绝对温度 (K)
E0:标准电极电位(standard electrode potential), aR = aO = 1 (标准温度)时的平衡电位
E0’:式量电位或条件电位(formal potential或conditionalpotential) 是基于浓度的标准电极电位。
Eeq:平衡电位 Eeq(根据参与反应的氧化-还原态物质的浓度比而改变的实验量)。
因此,平衡电位 Eeq是一个实验量,它可以根据参与反应的氧化还原物质的浓度比而改变。前面我们已经说明了,原电池的电动势可以使用能斯特方程从这些电活性物质的定量关系中计算出来。
◆电极反应动力学(1): 极化和过电位
当平衡被打破,可以看到反应开始向着一个方向进行时,该方向可以反映在电流的符号上(氧化电流为正,还原电流为负),例如,对于氧化反应为正反应的, 净反应速度V可以表示为氧化反应速度减去还原反应速度(式3)
这里,每个反应速度可以用反应物浓度 (mol cm-3) 与反应速度常数 k (cm s-1) 的乘积来表示,与均相反应体系的情况一样。那么 正向反应速度 Vox与逆向反应速度Vred可以表示为下面的式4和式5。
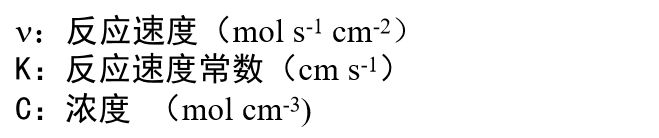
应该注意的是,这里出现的CRs和COs并不是指溶液本体中的浓度,而是指电极与溶液接触部分的浓度。以下称为表面浓度。
因为电流的绝对值与反应速度与成正比。氧化-还原电流和反应速率可以通过以下式6及式7的定量关系联系起来,观察到的净电流 I 可以表示为式8表示。
因为电流的绝对值与反应速度与成正比。氧化-还原电流和反应速率可以通过以下式6及式7的定量关系联系起来,观察到的净电流 I 可以表示为式8表示。
当反应发生并有电流流动时,电极电位开始从其先前的平衡电位值, 按照反应进行的方向和速度开始产生变化。 换句话说,"电位的移动是反应发生的结果",但反过来说,"强制使电位偏离平衡电位,可使反应得以进行"。
电位或电流 其中的一个可被用作控制变量,并对其进行主动改变,跟踪其他量如何响应这种变化,并做出理论解释。 这就是电化学测量方法的基本立场
顺便说一下,上述“使电位从平衡电位移动以引起反应”的操作和“由于反应而引起电位移动”的现象都用电化学中的术语“极化”来表示。 (偏离平衡电位的量称为过电压或过电位。)
其含义就是“要产生一定大小的电流,需要高于平衡电位的电压。”
当平衡电位以 Eeq 表示时,过电压 (符号为希腊字母 eta)为式9 定义的量。
电位或电流 其中的一个可被用作控制变量,并对其进行主动改变,跟踪其他量如何响应这种变化,并做出理论解释。 这就是电化学测量方法的基本立场
顺便说一下,上述“使电位从平衡电位移动以引起反应”的操作和“由于反应而引起电位移动”的现象都用电化学中的术语“极化”来表示。 (偏离平衡电位的量称为过电压或过电位。)
其含义就是“要产生一定大小的电流,需要高于平衡电位的电压。”
当平衡电位以 Eeq 表示时,过电压 (符号为希腊字母 eta)为式9 定义的量。
其中 E 是电极的电位。 图 1 显示了过电压和电流之间的关系。
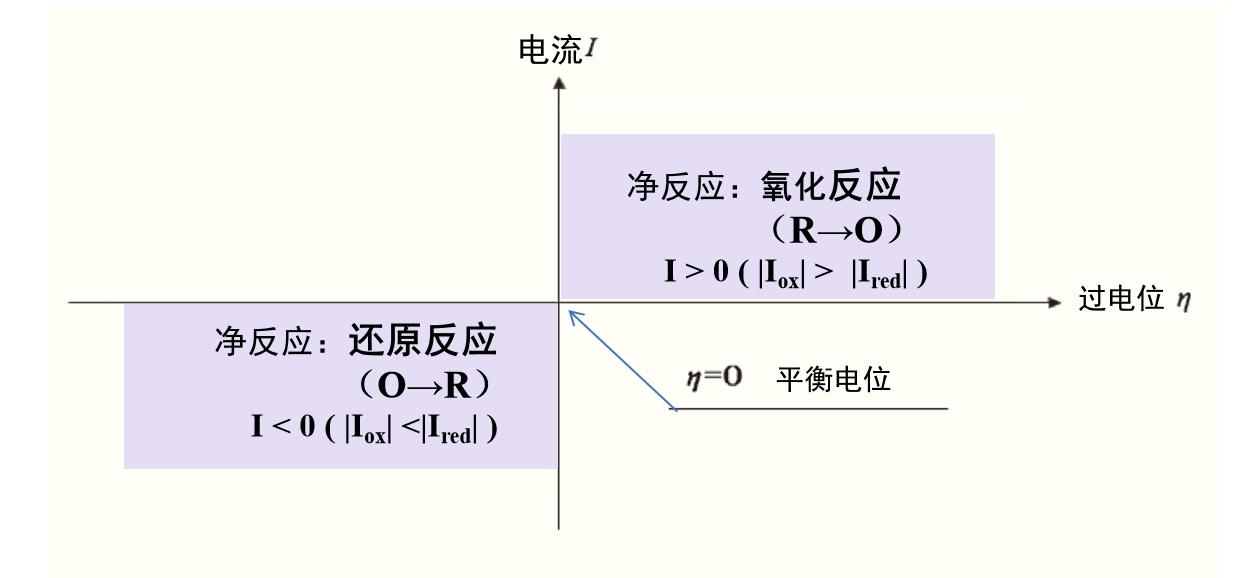
图1 过电位(超电势)和电流的关系
综上所述,当观察到非零电流时,无论大小如何,都会产生过电位(或超电势)。
