第5篇 电极反应动力学(5):(a)电极反应的可逆性 (b)当溶液中发生均相化学反应时
(a)电极反应的可逆性
描述化学反应时经常会用到可逆反应和不可逆反应这两个术语。 字面上可以理解为,即可正向又可以逆向进行的反应为可逆反应,而只能沿一个方向进行的反应 为不可逆反应。
从反应动力学的角度来看,正向和逆向反应具有相同大小的速度常数的为可逆反应,正向和逆向的反应速度常数中的其中一个与另一个相比之下,极大或极小的,为不可逆反应。
如前所述,在电化学反应的情况下,原则上可以通过控制电极电位来改变正反两个方向的反应速率,似乎反应都能可逆地进行。 但是,对与实际反应会有各种限制存在,要做到这一点并不容易。 例如,电极作为催化剂的许多反应,例如水的电解,以及各种有机物氧化成二氧化碳,这些反应是不可逆的。电极被用作催化剂的许多反应,不能可逆地进行。
当在电化学中讨论“反应的可逆性”时,很难像一般化学反应一样直观地理解它。其原因仍然是由于电子转移过程与物质传输过程相结合,而进行一系列反应的特殊现象。一般来说,根据标准电子转移反应速率常数的大小,将电化学反应分为三类:可逆体系、半可逆体系和不可逆体系(不可逆系统)(见图6),电流的流动变化由于与物质传输速率的相对关系,其方式复杂,因此很难用一个词来解释这些特性。上述活化过电压和浓度过电压中哪一个占主导地位的问题,也与电极反应的可逆性密切相关。由于传质过程的影响取决于测量时间尺度,因此有必要首先了解质量传递过程,以了解可逆性。
从反应动力学的角度来看,正向和逆向反应具有相同大小的速度常数的为可逆反应,正向和逆向的反应速度常数中的其中一个与另一个相比之下,极大或极小的,为不可逆反应。
如前所述,在电化学反应的情况下,原则上可以通过控制电极电位来改变正反两个方向的反应速率,似乎反应都能可逆地进行。 但是,对与实际反应会有各种限制存在,要做到这一点并不容易。 例如,电极作为催化剂的许多反应,例如水的电解,以及各种有机物氧化成二氧化碳,这些反应是不可逆的。电极被用作催化剂的许多反应,不能可逆地进行。
当在电化学中讨论“反应的可逆性”时,很难像一般化学反应一样直观地理解它。其原因仍然是由于电子转移过程与物质传输过程相结合,而进行一系列反应的特殊现象。一般来说,根据标准电子转移反应速率常数的大小,将电化学反应分为三类:可逆体系、半可逆体系和不可逆体系(不可逆系统)(见图6),电流的流动变化由于与物质传输速率的相对关系,其方式复杂,因此很难用一个词来解释这些特性。上述活化过电压和浓度过电压中哪一个占主导地位的问题,也与电极反应的可逆性密切相关。由于传质过程的影响取决于测量时间尺度,因此有必要首先了解质量传递过程,以了解可逆性。
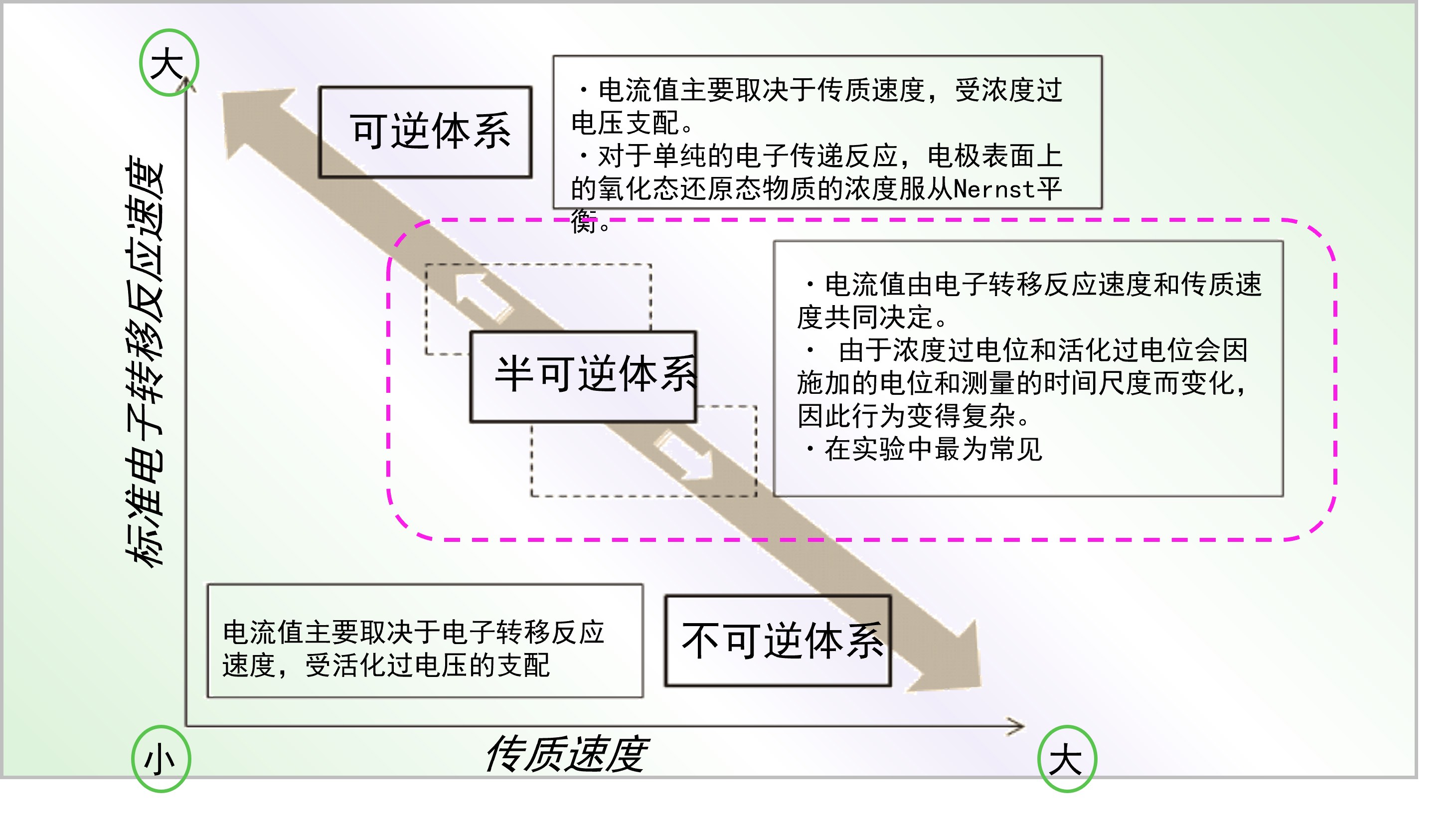
图6 电极反应可逆性的概念图。
通过电子转移反应速率,传质速率的相对大小关系来说明。
可以通过电子转移反应速度,传质速度的相对大小关系来说明或理解电极反应的可逆性。
图6 为电极反应可逆性的概念图。横轴表示传质速度,纵轴表示标准电子转移速度。对于标准电子转移速度和传质速度非常接近的半可逆体系而言具有以下特点:
・电流值由电子转移反应速度和物质传输速度共同决定。
・ 由于浓度过电压和活化过电压会因施加的电位和测量的时间尺度而变化,因此行为变得复杂。
・这种情况在实验中最为常见
对于电子传递速度远大于传质速度的体系为可逆体系, 该体系的电流值主要取决于传质速度,受浓度过电位支配。
・对于单纯的电子转移反应,电极表面上的氧化态还原态物质的浓度服从Nernst平衡。
再者,对于电子转移速度远小于传质速度的不可逆体系, 该体系的电流值主要取决于电子转移反应速度,受活化过电压的支配。
图6 为电极反应可逆性的概念图。横轴表示传质速度,纵轴表示标准电子转移速度。对于标准电子转移速度和传质速度非常接近的半可逆体系而言具有以下特点:
・电流值由电子转移反应速度和物质传输速度共同决定。
・ 由于浓度过电压和活化过电压会因施加的电位和测量的时间尺度而变化,因此行为变得复杂。
・这种情况在实验中最为常见
对于电子传递速度远大于传质速度的体系为可逆体系, 该体系的电流值主要取决于传质速度,受浓度过电位支配。
・对于单纯的电子转移反应,电极表面上的氧化态还原态物质的浓度服从Nernst平衡。
再者,对于电子转移速度远小于传质速度的不可逆体系, 该体系的电流值主要取决于电子转移反应速度,受活化过电压的支配。
(b)当溶液中发生均相化学反应时
本篇讨论的电极反应只是一种最简单的情况,一种反应物只在电极上发生电子转移反应,在讨论反应机理时这种反应过程称为E过程。但实际上电极上会进行多步电子转移反应比如下面图7中的EE过程。
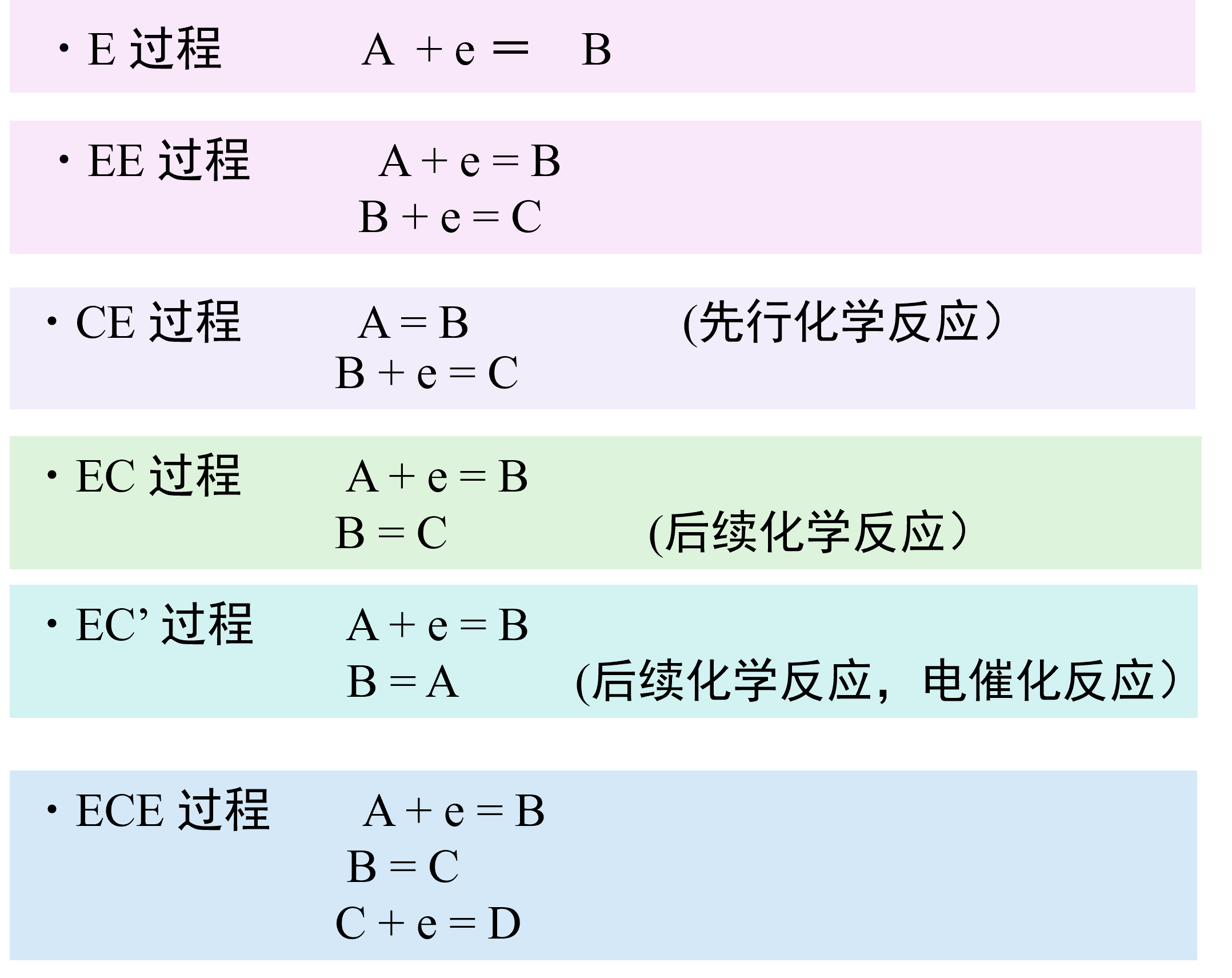
图7 当溶液中发生均相化学反应时的各种反应机理
另外,第一次电子转移反应产生的产物,继续发生化学反应变成另一种物质(称为后继化学反应),或与另一种物质交换电子成为原来的物质,很多情况下,它又返回到原来的状态(催化反应)。
在前一种情况下,从化学角度可以说反应是不可逆的,并且由于反向电子转移过程而产生的电流通常是观察不到的。在这些复杂的化学反应存在下,除了简单的电子转移过程外,电极表面的物质浓度受其影响很大,观察到的电流值也发生显着变化。在这种情况下,有必要在考虑反应机理的理论处理的基础上做出解释。
在前一种情况下,从化学角度可以说反应是不可逆的,并且由于反向电子转移过程而产生的电流通常是观察不到的。在这些复杂的化学反应存在下,除了简单的电子转移过程外,电极表面的物质浓度受其影响很大,观察到的电流值也发生显着变化。在这种情况下,有必要在考虑反应机理的理论处理的基础上做出解释。
