第四篇 光透薄层光谱电化学⟨1⟩
光透薄层池测定式量电位EO'和电子转移数n
1. 可逆反应
对于一个可逆反应体系,电极电位可以用Nernst 方程表示。
当向该体系施加某一电位时,为满足上述方程,物质即在电极表面发生氧化还原反应,从而由电流产生。尽管所加电位控制的是电极表面物质的浓度比(COx/CRed)surf,但由于薄层池溶液层很薄,溶液中物质 (COx/CRed)sol的浓度比很快被调节到与电极表面的比率相同.因此。平衡时
下面以可逆体系铁氰化钾为例加以说明,图4-1是不同外加电位下所记录的吸收光谱,外加电位由0.4开始,每改变一次电位待完全平衡后记录一次吸收光谱,选420nm波长下的吸收值作为测量铁氰化钾跟亚铁氰化钾量度。
完全为还原态时产生的吸光度为 AR =εRd C* (4-5)
任意中间电位处的吸光度 Ai=(εOCO +εRCR)d (4-6)
当不存在任何化学反应,时有 CO+ CR = C* (4-7)
根据式4-3至4-7可以得出
COX =(Ai -AR) / [d (εO- εR)] (4-8)
CRed = (AO -Ai) / [d (εO- εR)] (4-9)
将上两式代入式4-2(Nernest),得到
E = EO’ +( 0.05916/n) lg{r(E)} (4-10)
COX /CRed= r (E) = [ (Ai -AR) /(AO -Ai) ] (4-11)
式中 AR是铁氢根离子Fe(CN)63-完全还原成亚铁氰根离子Fe(CN)64-时的吸光度。AO为完全为氧化态时的吸光度, Ai为Fe(CN)63- 和Fe(CN)64-共存时的吸光度将外加电压E对
lg{r(E)}作图,得到一条直线。
图4-2 为 K3FeCN6 体系的Nernst作图得到的一条直线,其斜率为59.6 mV, 计算出 电子转移数 n=0.99,相当于单电子电极反应。由其截距得式量电位 EO’ =0.275V vs. SCE (甘汞电极)四次测量的标准偏差为0.001,与文献报道值基本相符。该实验中重要的是进行测量时,溶液要与电极电位达平衡及所有的光吸收变化停止,工作电极上仅通过较小的残余电流和由于边缘效应所产生的较小电流。
![图4-1 铁氰化钾在不同外加电位下在光透薄层电解池中记录的吸收光谱[1] 图4-1 铁氰化钾在不同外加电位下在光透薄层电解池中记录的吸收光谱[1]](http://als-japan.com.cn/xdata/technical/fig4-1-thinlayer.jpg)
图4-1 K3FeCN6在不同外加电位下在光透薄层电解池中记录的吸收光谱[1]
1mol/L K3FeCN6(0.1mol/L KNO3), 薄层池厚 0.24mm,
外加电位 (a)0.4, (b)0.32, (c)0.30, (d)0.28, (e)0.26, (f)0.24,(g)0.22, (h) 0.00V ( vs. Ag/AgCl)
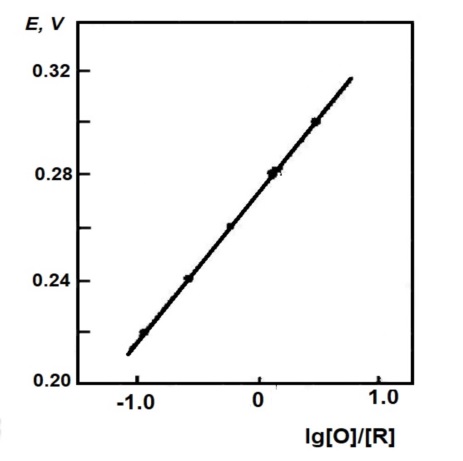
图4-2 K3FeCN6体系的体系的Nernst作图。
2. 准可逆反应
这类体系的典型例子是第一章中提到的维生素B12,其第一电子还原步骤的电子转移速率相当慢,即使在直流极谱中所用的慢速扫以下几乎观察不到还原波,直到电位足够负时,产生一个二电子的还原波。图4-3是其负向电位扫描时的循环伏安图。在Epc等于负0.93V vs. SCE 电位下,呈现一个两电子还原峰。而薄层光谱恒电位实验显示出两个连续的,易于分辨的一电子还原步骤。
![图4-3 1mmol/L 维生素B12的伏安法,Britton-Robinson 缓冲溶液pH6.86,Hg-Au网栅光透电极 a.薄层循环伏安法 b. 388nm处的吸光度对电位作图[3] 图4-3 1mmol/L 维生素B12的伏安法,Britton-Robinson 缓冲溶液pH6.86,Hg-Au网栅光透电极 a.薄层循环伏安法 b. 388nm处的吸光度对电位作图[3]](http://als-japan.com.cn/xdata/technical/fig4-3-thinlayer.jpg)
图4-3 1mmol/L 维生素B12的伏安法,
Britton-Robinson 缓冲溶液(pH6.86),Hg-Au网栅光透电极
(a)薄层循环伏安法 (b)388nm处的吸光度对电位作图[3]
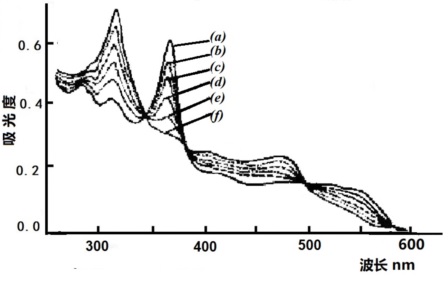
图4-4 B12还原为B12red 的薄层光谱
外加电位:(a)-0.550;(b)-0.630 ;(c)-0.660;(d)-0.690;(e)-0.720;
(f) -0.770V vs. SCE [3] 。

图4-5 B12red还原为B12red 的薄层光谱
外加电位:(a)-0.770;(b)-0.820 ;(c)-0.860;(d)-0.880;(e)-0.900; (f) -0.920 (g) -1.000V vs. SCE [3] 。
第二个光谱变化出现在-0.77至-0.95V的电位范围内, 如图4-5所示,-0.770V下的起始光谱为B12即Co(II)的光谱,逐渐向负电位阶跃后,产生 -1.000V 下的B12, 一价钴的光谱。在368nm处的吸光度数据经Nernst作图表明,该吸光度变化也对应于一电子还原过程,其式量电位E1/2=-0.880V。
3. 采用媒介体(Mediator)的生物氧化还原体系
很多生物物质如血红蛋白、肌红蛋白等在电极上的直接异相电子转移速率非常慢,这种行为通常是由于其在电极表面的强烈吸附以及电活性中心被其多肽链包围所致,这些生物物质很难采用通常的电化学方法来进行研究。对于这种体系,通常的方法是向溶液中加入媒介体来调节电极与生物组分间的电子转移,原理为∶
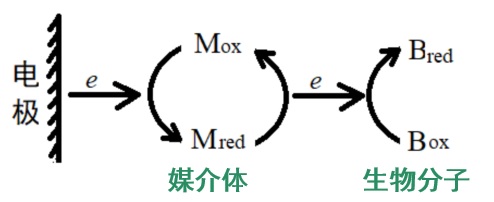
(4-12)
E = EO’B+ (RT / nBF) ln{ [OB] / [RB] } (4-14)
以细胞色素C为例[4],细胞色素C 在金网栅电极光透薄层池中无明显的氧化还原峰,但当溶液中加入2,6-二氯苯酚-靛酚(DICP)作为媒介体后,细胞色素C通过与 DICP发生反应,其氧化/还原的速率大大提高。不同电位下,细胞色素 C的光谱如图4-6所示,细胞色素C在300mV vs.SCE下被完全氧化,而在-600mVvs.SCE下被完全还原,光谱是在平衡条件下记录的,即电流下降到可忽略的水平,光谱的变化停止。施加的电位每变化一次,约需10min达到平衡,该平衡时间与媒介体的浓度及光透薄层池的设计有关,由细胞色素C的Nernst作图所得的截距和斜率分别给出EO’B=0.261±0.001V vs. NHE及 a=1(25°C)。因此,对于在金电极上电化学不可逆的生物氧化还原体系,可得到非常精确的EB的式量电位值。
对于某些生物体系来说,通过媒介体与生物组分的氧化还原来控制溶液电位对测定EO’是很重要的。如在媒介体不存在 的 条件下,在光透薄层池中电解细胞色素C需要几小时,而采用合适的媒介体则只需几分钟。
选择媒介体的基本要求是∶媒介体要快速可逆地与电极进行异相电子交换及与生物分子的均相电子转移;氧化态和还原态均能稳定存在;其光谱与生物组分的光谱不发生重叠。
用薄层光谱电化学的方法还可以较方便地测定体系的热力学函数。在不同温度下,测定同一体 系 的 E-{1g[O]/[R]}关系曲线,由测得的式量电位 EO’随温度的变化即可求得ΔS°和ΔH°等热力学参数
(əE°'/əT)=Δs°/nF 4-15)
ΔH°=- nFE°'+ΔS° (4-16)
图4-7是星状花青苷在不同温度下的Nernst图,测得该体系的
EO’ =184(±1mV)vs. NHE(25°C), ΔH° =-71(±4)kJ/ mol, ΔS°=-44 (±3) eu。
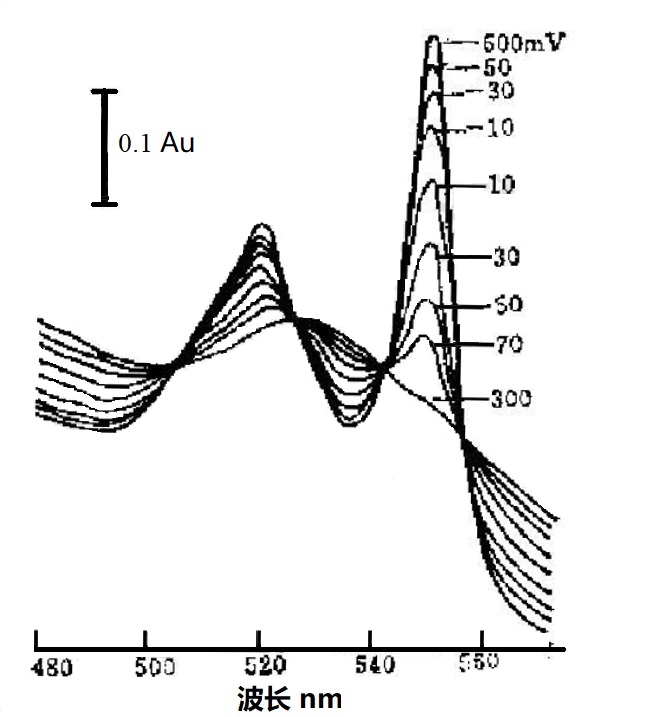
图4-6 不同外加电位下,细胞色素C与2,6-二氯靛酚(DICP)媒介体的薄层光谱, 0.5 mol/L磷酸盐缓冲液(pH7.0)[4] 。
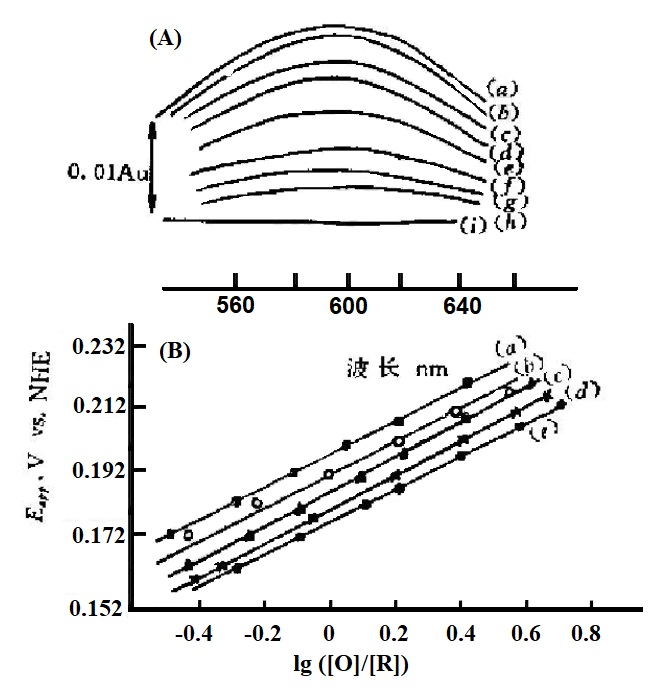
图4-7 (A)星状花青苷在不同外加电位下的薄层光谱。
2.7×10-8 mol/L星状花青苷及 2.8×10-8mol/L Ru(NH3)Py3+,池厚0.021cm, 外加电位∶(a)240;(b)230;(c)220;(d)210;(e)190;(f)175;(9)150;(h)145;(i)90mV vs.NHE.
(B)不同温度下的Nernst图[5]
参考文献
[4-1]宋士华,程广金,董绍俊、分析化学, 15, 461(1987).
[4-2] T. M. Kenyhercz, T. P. DeAngelis, B. J. Norris, W. R. Heineman, and H. B. Mark P, J. Am. Chem. Soc., 1976, 98, 9, 2469–2477
[4-3] Kenneth A. Rubinson, Eiki. Itabashi, and Harry B. Mark, Inorg. Chem., 1982, 21, 9, 3571-3573 .
[4-4] W.R.Heineman,B.J.Norris and J. F. Gaelz, Anal. Chem., 1975, 47, 1, 79–84.
[4-5] N. Sailasuta,F. C. Anson and H. B. Gray,J. Am. Chem. Soc., 1979, 101 (2), 455-458.
